Nükleosid ve nükleotid ters transkriptaz inhibitörlerinin keşfi ve geliştirilmesi - Discovery and development of nucleoside and nucleotide reverse-transcriptase inhibitors
Nükleosid ve nükleotid ters transkriptaz inhibitörlerinin (NRTI'ler ve NtRTI'ler) keşfi ve gelişimi , AIDS salgınının Batı toplumlarını vurduğu 1980'lerde başladı . NRTI'ler , insan immün yetmezlik virüsünün ( HIV ) genetik materyalinin replikasyonunu kontrol eden bir enzim olan ters transkriptazı (RT) inhibe eder . İlk NRTI olduğu zidovudin ABD tarafından onaylanmış, Gıda ve İlaç İdaresi , HIV tedavisinde yönelik ilk adım 1987'de (FDA). Bunu altı NRTI ajanı ve bir NtRTI izlemiştir. NRTI'ler ve NtRTI, endojen 2'-deoksi-nükleosit ve nükleotidin analoglarıdır. İlaca dirençli virüsler , HIV-1'in anti-HIV ilaçlarına uzun süre maruz kalmasının kaçınılmaz bir sonucudur.
Tarih
1981 yazında, edinilmiş immün yetmezlik sendromu (AIDS) ilk kez rapor edildi. İki yıl sonra, AIDS'in etiyolojik bağlantısı olan insan immün yetmezlik virüsü (HIV) tanımlandı. HIV'in tanımlanmasından bu yana, etkili antiretroviral ilaçların geliştirilmesi ve HIV araştırmalarındaki bilimsel başarılar çok büyük olmuştur. HIV enfeksiyonlarının tedavisi için antiretroviral ilaçlar altı kategoriye aittir: Nükleozid ve nükleotid ters transkriptaz inhibitörleri, Nükleozid olmayan ters transkriptaz inhibitörleri , proteaz inhibitörleri , giriş inhibitörleri, ko-reseptör inhibitörleri ve integraz inhibitörleri. HIV-1'in ters transkriptazı, anti-HIV ilaçlarının geliştirilmesinin ana temeli olmuştur. İn vitro anti-HIV aktivitesine sahip ilk nükleozid ters transkriptaz inhibitörü zidovudindi. Zidovudin 1987'de onaylandığından beri, altı nükleosit ve bir nükleotid ters transkriptaz inhibitörü (NRTI) FDA tarafından onaylanmıştır. FDA tarafından onaylanan NRTI'ler zidovudin, didanosin , zalsitabin , stavudin , lamivudin , abakavir ve emtrisitabindir ve onaylanan tek nükleotid ters transkriptaz inhibitörü (NtRTI) tenofovirdir (bkz. tablo 4).
HIV-1 ters transkriptaz enzimi
İşlev
Çoğu standart HIV ilaç tedavisi, HIV-1 virüsü ve diğer retrovirüsler için yaşam döngülerini tamamlamak için gerekli olan bir enzim olan ters transkriptaz enziminin (RT) engellenmesi etrafında döner . RT enzimi iki temel fonksiyona hizmet eder. Birincisi, polimeraz aktivitesi aracılığıyla virüslerin genetik materyalinin replikasyonunu kontrol eder . Viral tek sarmallı RNA'yı entegrasyon yetkin çift sarmallı DNA'ya dönüştürür . Daha sonra, üretilen DNA, retroviral integraz ile genomuna entegre edildiği konak hücrenin çekirdeğine yer değiştirir . RT'nin diğer rolü, yalnızca DNA ile bir heterodubleks içinde olduğunda RNA'yı bozan ribonükleaz H aktivitesidir .
Yapı
HIV-1 RT, 1000 amino asit uzunluğunda ve iki alt birimden oluşan asimetrik bir heterodimerdir . Daha büyük alt birim olan p66, 560 amino asit uzunluğundadır ve RT'nin tüm enzimatik aktivitelerini sergiler. p51 adı verilen daha küçük alt birim, 440 amino asit uzunluğundadır ve heterodimeri stabilize ettiği kabul edilir, ancak aynı zamanda tRNA primerinin bağlanmasında da yer alabilir . p66 alt birimi iki aktif bölgeye sahiptir: polimeraz ve ribonükleaz H. Polimerazın sağ el ile kıyaslandığı için "parmak", "başparmak", "bağlantı" ve "avuç içi" olarak adlandırılan dört alt alanı vardır.
Hareket mekanizması
Nükleosid ve nükleotid ters transkriptaz inhibitörlerinin aktivasyonu, öncelikle pasif difüzyon veya taşıyıcı aracılı taşıma ile hücresel girişe bağlıdır . NRTI'ler oldukça hidrofiliktir ve sınırlı membran geçirgenliğine sahiptir ve bu nedenle bu adım çok önemlidir. NRTI'ler, endojen 2'-deoksi-nükleosit ve nükleotidin analoglarıdır . Ana formlarında inaktiftirler ve ardışık fosforilasyon gerektirirler .
Nükleozidler trifosforillenmeli, bir fosfonat grubuna sahip nükleotidler ise difosforile edilmelidir. Bu adım adım aktivasyon işlemi hücre içinde gerçekleşir ve koordineli bir dizi enzim aracılık eder. İlk ve sıklıkla hız sınırlayıcı fosforilasyon adımı (nükleozid analogları için) en yaygın olarak deoksinükleozid kinazlar tarafından katalize edilir. İkinci fosfat grubunun nükleosit monofosfat analoglarına eklenmesi, nükleosit monofosfat kinazlar (NMP kinazlar) tarafından tamamlanır. Çeşitli enzimler, nükleozid difosfat kinaz (NDP kinaz), fosfogliserat kinaz , piruvat kinaz ve kreatin kinaz dahil olmak üzere NRTI'ler için son fosforilasyon adımını katalize edebilir ve ilgili antiviral olarak aktif trifosfat analoglarının oluşumuyla sonuçlanır . İlgili trifosfat formlarında, NRTI'ler ve mevcut olan tek NtRTI, yeni oluşan DNA zincirine dahil edilmek için karşılık gelen endojen deoksinükleotit trifosfat (dNTP'ler) ile rekabet eder (bakınız şekil 1). dNTP substratından farklı olarak, NRTI'ler deoksiriboz parçası üzerinde bir 3'-hidroksil grubundan yoksundur . DNA zincirine dahil edildikten sonra, normal olarak bir sonraki nükleik asit ile 5'- ila 3'- fosfoester bağı oluşturan bir 3'-hidroksil grubunun yokluğu , DNA'nın RT ile daha fazla uzamasını engeller ve zincir görevi görürler. sonlandırıcılar.
Keşif ve geliştirme
HIV-zidovudin tedavisine doğru ilk adım
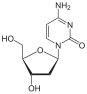
1964 yılında zidovudin (AZT), Michigan Kanser Vakfı'nda Horwitz tarafından sentezlendi. Timidinin deoksiriboz halkasındaki 3'hidroksil grubu , bize zidovudin veren bir azido grubu ile değiştirilir . Ters transkripsiyon sırasında büyüyen DNA zincirinde bir sonraki nükleotit için bağlanma noktası sağlayan 3'hidroksil grubunun olmaması onu zorunlu zincir sonlandırıcı yapar. Ziduvodin, timidin yerine dahil edilmiştir ve HIV replikasyonunun son derece güçlü bir inhibitörüdür . Bu bileşik, 1964'te potansiyel bir anti-kanser ajanı olarak hazırlanmıştı, ancak etkisiz olduğu gösterildi. 1974'te zidovudinin retrovirüslere karşı aktiviteye sahip olduğu bildirildi ve daha sonra AIDS salgını 1980'lerin ortalarında Batı toplumlarını vurduğunda bir antiviral olarak yeniden tarandı. Bununla birlikte, zidovudin, hücresel enzimler tarafından trifosfata dönüştürüldüğü ve bu nedenle enfekte olmayan hücrelerde aktive edildiğinden nispeten toksiktir .
Nükleozid analoglarının daha da geliştirilmesi
dideoksinükleositler
| dideoksiadenozin | didanosin | |
|---|---|---|
| Kimyasal
yapı |

|

|
Dideoksinükleositler, şeker halkasının hem 2' hem de 3'-hidroksil gruplarından yoksun olduğu nükleosit analoglarıdır. Zidovudin sentezinden üç yıl sonra , Jerome Horwitz ve Chicago'daki meslektaşları, şimdi zalsitabin (ddC) olarak bilinen başka bir dideoksinükleosid hazırladılar. Zalsitabin, riboz şeker parçasının 3'-hidroksil grubunun hidrojen ile ikame edildiği , yapısal olarak deoksisitidin ile ilişkili sentetik bir pirimidin nükleozid analoğudur . Zalsitabin, Haziran 1992'de HIV-1 tedavisi için FDA tarafından onaylandı.
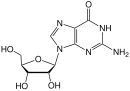
2',3'-dideoksiinosin veya didanosin , in vivo olarak dideoksiadenosine dönüştürülür. Gelişimi uzun bir geçmişe sahiptir. 1964 yılında dideoksiadenosin, zalsitabinin karşılık gelen adenosin analoğu sentezlendi. Dideoksiadenosin böbrek hasarına neden oldu, bu nedenle didanosin, enzimatik oksidasyon ile dideoksiadenozinden hazırlandı (bkz. Tablo 1). Böbrek hasarına neden olmadan HIV'e karşı aktif olduğu bulundu. Didanosin, Ekim 1991'de HIV-1 tedavisi için FDA tarafından onaylandı. Zalsitabin ve didanosin, HIV'e karşı tedavi için geliştirilmiş zorunlu zincir sonlandırıcılardır. Ne yazık ki, her iki ilaç da seçicilikten yoksundur ve bu nedenle yan etkilere neden olur .
| zalsitabin | Lamivudin | |
|---|---|---|
| Kimyasal
yapı |
|

|
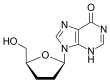
Dideoksi çerçevesinin daha fazla modifikasyonu, 2',3'-didehidro-3'-deoksitimidin (stavudin, d4T) geliştirilmesine yol açtı. Stavudinin aktivitesinin, fosforilasyon paternleri farklı olsa da, zidovudine benzer olduğu gösterilmiştir;
afinite zidovudin için timidin kinaz (ilk fosforilasyonundan sorumlu enzim) ile benzerdir timidin afinite ise,
stavudin daha zayıf 700 kat fazladır.
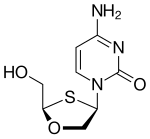
2',3'-dideoksi-3'-tiasitidin (lamivudin, 3TC), Bernard Belleau tarafından keşfedilmiştir . Tarih
Bernard Belleau şeker türevlerini araştırırken lamivudin'in miktarı 1970'lerin ortalarına kadar izlenebilir . Lamivudin, zalsitabinin kükürt analoğu olarak geliştirilmiştir (bkz. Tablo 2). Başlangıçta rasemik bir karışım (BCH-189) olarak sentezlendi ve analiz , BCH-189'un (2',3'-dideoksi-3'-tiasitidin) hem pozitif hem de negatif enantiyomerlerinin HIV'e karşı in vitro aktiviteye sahip olduğunu gösterdi. Lamivudin, negatif enantiyomerdir ve bir pirimidin nükleozid analoğudur. 2'-deoksisitidinin riboz halkasının 3' karbonu, daha yüksek anti-HIV aktivitesine sahip olduğu ve pozitif enantiyomerden daha az toksik olduğu için bir kükürt atomu ile değiştirilmiştir.
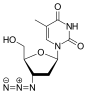
Sırada , lamivudinin yapısal bir homologu olan 2',3'-dideoksi-5-floro-3'-tiasitidin (Emtricitabine, FTC) vardı . Yapısal fark, lamivudinin baz parçasının 5-floro-modifikasyonudur. Birçok yönden lamivudine benzer ve hem HIV-1 hem de hepatit B virüsüne ( HBV ) karşı aktiftir .
karbosiklik nükleosit
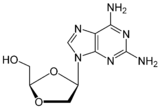
Dideoksiadenosinin karbosiklik analogları, anti-HIV aktiviteleri için araştırıldı. Önce minimal aktivite gözlemlendi. Birçok nükleozid analogu hazırlanmış ve incelenmiştir ancak sadece bir tanesi önemli aktiviteye sahipti ve klinik kullanım gerekliliklerini karşıladı . Bu, dideoksiadenosinin 2',3'-didehidro analoğuydu. Bir yerleştirilmesi siklopropil olan 6-amino grubunda nitrojen ve adenin halkası artan lipofilisite ve böylece arttırılmış beyin penetrasyonu. Elde edilen bileşik abakavir olarak bilinir (bkz. Tablo 3). Abacavir, Aralık 1998'de HIV-1 enfeksiyonlarının tedavisinde kullanılmak üzere FDA tarafından onaylandı.
Bu ilaç, in vivo olarak bir guanozin analoğu olarak aktif olan tek onaylanmış antiretroviraldir . İlk önce adenozin fosfotransferaz tarafından monofosforile edilir ve daha sonra monofosfat karbovir 3´-monofosfata dönüştürülür. Daha sonra, tamamen fosforile olur ve karbovir, RT tarafından DNA zincirine dahil edilir ve bir zincir sonlandırıcı olarak görev yapar. Carbovir, oral biyoyararlanımı zayıf olan ilgili bir guanozin analoğudur ve bu nedenle klinik geliştirmeden çekilmiştir.
| dideoksiadenozin | didanosin | abakavir | |
|---|---|---|---|
| Kimyasal yapı |

|

|
|
Asiklik nükleotid – tek onaylı NtRTI
Nükleotid analogları sadece iki fosforilasyon adımı gerektirirken, nükleosit analogları üç adım gerektirir. Fosforilasyon gereksinimindeki azalma, ilaçların aktif metabolitlerine daha hızlı ve tam dönüşümüne izin verebilir. Bu tür düşünceler, tenofovir gibi fosfonat nükleotit analoglarının geliştirilmesine yol açmıştır. Tenofovir disoproksil fumarat (Tenofovir DF), tenofovirin ön ilacıdır . Tenofovir, bir asiklik adenosin türevidir. Bileşiğin asiklik doğası ve fosfonat kısmı, onaylanmış NRTI'ler arasında benzersiz yapısal özelliklerdir. Tenofovir DF, anti-HIV aktivitesi sergileyen tenofovire enzimatik olarak hidrolize edilir . 2,3-dihidroksipropiladeninin sentezi ve geniş spektrumlu antiviral aktivitesi ile geliştirilmiştir . Tenofovir DF, Ekim 2001'de HIV-1 enfeksiyonunun tedavisi için FDA tarafından onaylanan ilk nükleotid ters transkriptaz inhibitörüydü.
Burada hiçbir şey yazmıyorsa tablo neden sonraki bölüm başlığını yiyor?
Direnç
Şu anda, ilaca dirençli virüslerin ortaya çıkması, HIV-1'in antiretroviral tedaviye uzun süre maruz kalmasının kaçınılmaz bir sonucudur. İlaç direnci, viral enfeksiyonun tedavisinde ciddi bir klinik sorundur ve HIV tedavisinde özellikle zor bir sorundur. Direnç mutasyonları, onaylanmış tüm NRTI'ler için bilinmektedir.
NRTI ilaç direncine neden olan iki ana mekanizma bilinmektedir: NRTI'lerin dahil edilmesiyle etkileşim ve dahil edilen NRTI'lerin kesilmesi. Dahil edilen NRTI'lerle etkileşim, RT'nin p66 alt alanındaki bir mutasyonu içerir . Mutasyon, bazı ilaçların, örneğin lamivudin'in ters transkripsiyon sırasında dahil edilmesini dışlayabilen sterik bir engele neden olur . Dahil edilen NRTI'lerin kesilmesi durumunda dirençli enzimler, inhibitörü DNA zincirine dahil edilmek üzere bir substrat olarak kolayca kabul eder. Ardından, RT enzimi, polimerizasyon aşamasını tersine çevirerek dahil edilen NRTI'yi çıkarabilir . Eksizyon reaksiyonu, RT'nin 3'primer terminalinde NRTI'ye katıldığı ve onu primer DNA'dan kestiği bir pirofosfat donörü gerektirir. Hastalarda HIV-1 replikasyonunun etkin bir şekilde inhibisyonunu sağlamak ve ilaca dirençli virüslerin ortaya çıkmasını geciktirmek veya önlemek için ilaç kombinasyonları kullanılır. Yüksek derecede aktif antiretroviral tedavi olarak da bilinen HAART , NRTI'ler, NtRTI, nükleozid olmayan ters transkriptaz inhibitörleri ve proteaz inhibitörlerini içeren antiviral ilaçların kombinasyonlarından oluşur.
Şu anki durum
Şu anda, klinik ve klinik öncesi gelişimin çeşitli aşamalarında birkaç NRTI vardır . HIV-1'e karşı yeni NRTI arayışına devam etmenin ana nedenleri, toksisiteyi azaltmak, dirençli virüslere karşı etkinliği artırmak ve anti-HIV-1 tedavisini basitleştirmektir.
Aprisitabin (ATC)
Aprisitabin bir deoksisitidin analoğudur. Oksijen ve kükürt pozisyonlarının esasen tersine döndüğü lamivudin ile yapısal olarak ilişkilidir . Aprisitabin, diğer bazı NRTI'lere kıyasla in vitro olarak biraz daha az etkili olmasına rağmen, NRTI direnç mutasyonları olan geniş bir HIV-1 varyantı yelpazesine karşı etkinliğini korur. Aprisitabin, NRTI deneyimli hastaların tedavisi için klinik geliştirmenin son aşamasındadır.
Elvusitabin (L-d4FC)
Elvusitabin , zidovudin ve lamivudin dahil olmak üzere diğer birçok nükleozid analoglarına dirençli HIV'e karşı aktiviteye sahip bir deoksisitidin analoğudur. Bu kısmen , hücrelerde ulaşılan trifosfat metabolitinin yüksek hücre içi seviyeleri nedeniyledir . Elvusitabinin klinik denemeleri beklemededir, çünkü bazı hastalarda kemik iliği baskılanması göstermiştir ve CD4+ hücre sayıları doz uygulamasının başlamasından iki gün sonra bile düşmüştür.
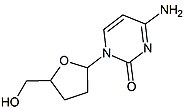
Amdoksovir (DAPD)
Amdoxovir , iyi biyoyararlanımı olan bir guanozin analoğu NRTI ön ilacıdır. Bu tarafından hücre içine olacak deamine edilmesiyle adenosin deaminaz için dioksolan guanin (DXG). İlacın aktif formu olan DXG-trifosfat, DAPD-trifosfattan daha fazla aktiviteye sahiptir. Amdoxovir şu anda faz II klinik denemelerindedir.
Racivir (RCV)
Racivir , emtrisitabin (FTC), (-)-FTC ve (+)-FTC'nin iki β-enantiyomerinin rasemik bir karışımıdır. Racivir'in mükemmel oral biyoyararlanımı vardır ve günde sadece bir kez alınması gerekme avantajına sahiptir. Racivir, iki NRTI'nin kombinasyonu olarak kullanılabilir ve kombinasyon halinde kullanıldığında umut verici antiviral aktivite göstermiştir. Racivir şu anda faz II klinik denemelerindedir.
Geliştirme aşamasında olan birkaç NRTI daha var. Sponsorlar ya bir Araştırmaya Dayalı Yeni İlaç (IND) başvurusunda bulunmuş, başvuru FDA tarafından onaylanmış ya da ilaçlar klinik denemelerin farklı aşamalarındadır. Geliştirilmekte olan bazı NRTI'ler, yeni ajanlara ihtiyaç duyan hastaların tedavisi için onları arzu edilir hale getirebilecek çeşitli çekici farmakolojik özellikler sergilemektedir.
Ayrıca bakınız
- antiretroviral ilaç
- CCR5 reseptör antagonistlerinin keşfi ve geliştirilmesi
- Nükleozit Olmayan Ters Transkriptaz İnhibitörlerinin Keşfi ve Geliştirilmesi
- HIV Proteaz İnhibitörlerinin Keşfi ve Geliştirilmesi
- Ters transkriptaz inhibitörü
- proteaz inhibitörü
- giriş inhibitörü
- HIV proteaz inhibitörlerinin keşfi ve geliştirilmesi
- CCR5 reseptör antagonistlerinin keşfi ve geliştirilmesi