HIV-proteaz inhibitörlerinin keşfi ve geliştirilmesi - Discovery and development of HIV-protease inhibitors
Birçok önemli fizyolojik süreç, proteolitik enzim aktivitesinin düzenlenmesine bağlıdır ve bir enzim ile substratları arasındaki denge bozulduğunda dramatik sonuçlar olabilir . Bu prospektifte, katalitik aktiviteleri modüle edebilen proteaz inhibitörleri gibi küçük moleküllü ligandların keşfi muazzam bir terapötik etkiye sahiptir. Bu nedenle, HIV proteazının inhibisyonu, HIV enfeksiyonunda terapötik müdahale için en önemli yaklaşımlardan biridir ve bunların geliştirilmesi, yapı temelli ilaç tasarımının büyük başarısı olarak kabul edilir . HIV'e karşı oldukça etkilidirler ve 1990'lardan beri HIV/ AIDS için anti-retroviral tedavilerin önemli bir bileşeni olmuştur .
Tarih
İnsan immün yetmezlik virüsü (HIV) bir olduğunu lentivirüs , iki büyük tür barındıran , HIV-1 çoğunluğunu neden salgın ve HIV-2 , kimin dağıtım batı Afrika'da yoğunlaştığı yakın akrabası. HIV enfeksiyonu ilk olarak 1981 yılında San Francisco ve New York'ta tanımlanmıştır. 1985 yılında HIV, edinilmiş immün yetmezlik sendromunun (AIDS) etken maddesi olarak tanımlandı ve tam genomu hemen kullanıma sunuldu. Bu bilgi seçici inhibitörlerin gelişiminin yolunu açmıştır .
HIV-2, HIV-1'den biraz daha düşük bulaşma riski taşır ve enfeksiyon, AIDS'e daha yavaş ilerleme eğilimindedir. Yaygın kullanımda HIV genellikle HIV-1'i ifade eder.
HIV-1 proteaz, en iyi bilinen aspartik proteazlardan biridir ve AIDS tedavisi için çekici bir hedeftir.
HIV proteazın keşfinden sonra ilk inhibitörünün pazara ulaşması sadece 10 yıl aldı. Yüksek ölçüde seçici konusundaki ilk raporlar antagonistleri HIV proteazı karşısında 1987. Faz I çalışmalarda ortaya çıkarılmıştır sakuinavir , 1989 yılında ve 1995 dört ay sonra, diğer iki proteaz inhibitörleri olarak ilaç kullanım için onaylanmış ilk HIV proteaz inhibitörü olduğunu ritonavir ve indinavir onaylandı. 2009'da on proteaz inhibitörü HIV'e karşı tedavi için pazara ulaştı, ancak bir proteaz inhibitörü olan amprenavir 2004'te piyasadan çekildi.
HIV'in yaşam döngüsü
HIV , RNA biçiminde genetik bilgi taşıyan retrovirüsler adı verilen virüs sınıfına aittir . HIV , yüzeylerinde CD4 antijeni taşıyan T hücrelerini enfekte eder . HIV, hedef hücresine bulaştığında, viral ve hücresel zarların kaynaşmasını gerektirir. İlk adım, virüsün zarf proteinleri (gp120, gp41) ile hedef hücre üzerindeki spesifik konakçı hücre yüzey reseptörleri (örn. CD4 reseptörü) arasındaki etkileşimdir. Daha sonra virüs bağlandığı kemokin koreseptörlere CXCR4 ya da CCR5 zarf proteinleri konformasyonel değişikliklere neden. Bu füzyon, viral kapsidin hücreye girdiği bir gözenek oluşturur . Hücreye girdikten sonra virüsün RNA'sı, viral olarak kodlanmış ilk enzim olan ters transkriptaz tarafından DNA'ya ters kopyalanır . Viral DNA , viral olarak kodlanmış ikinci bir enzim olan integraz tarafından hücrenin genetik materyaline entegre edildiği çekirdeğe girer . Konak hücrenin aktivasyonu , viral DNA'nın mRNA'ya transkripsiyonuna yol açar . mRNA daha sonra viral proteinlere çevrilir ve viral olarak kodlanmış üçüncü enzim, yani HIV proteaz, bir viral poliprotein öncüsünü tek tek olgun proteinlere bölmek için gereklidir. Viral RNA ve viral proteinler hücre yüzeyinde bir araya gelerek yeni viryonlar oluştururlar . Virionlar hücreden tomurcuklanır ve diğer hücreleri enfekte etmek için serbest bırakılır. Enfekte olmuş tüm hücreler, konağın genetik sisteminin yok edilmesinden viryonların tomurcuklanmasına ve salınmasına kadar bu geniş hücre hasarı nedeniyle sonunda öldürülür.
Hareket mekanizması
HIV yaşam döngüsünde, müdahale edilebilecek, böylece virüsün replikasyonunu durdurabilecek birkaç adım vardır. Çok kritik bir adım, polipeptit öncülerinin , HIV proteaz tarafından katalize edilen olgun enzimlere ve yapısal proteinlere proteolitik bölünmesidir . HIV proteaz inhibitörleri, virüs aspartil proteazının etkisini rekabetçi bir şekilde inhibe eden peptit benzeri kimyasallardır. Bu ilaçlar, virüsün temel yapısal ve enzimatik bileşenlerini içeren HIV Gag ve Pol poliproteinlerinin proteolitik bölünmesini önler. Bu, HIV partiküllerinin olgun bulaşıcı formlarına dönüşmesini engeller.
Proteaz inhibitörleri, çoğu HIV proteaz inhibitörünün kullanımıyla ilişkili yaygın bir yan etki olan lipodistrofiye neden olan adiposit metabolizmasını değiştirebilir . Adiposit farklılaşmasının inhibisyonu , trigliserit birikimi ve artan lipoliz gibi birçok mekanizma önerilmiştir . Proteaz inhibitörlerinin insülinle uyarılan glukoz alımı üzerindeki etkisini dikkate alan teoriler de lipodistrofik sendromla ilişkilendirilmiştir. Proteaz inhibitörlerinin, insülin sinyalleşmesinde erken aşamaların inhibisyonunu temsil eden, IRS-1'in insülin ile uyarılan tirozin fosforilasyonunda bir azalmaya neden olması mümkündür . Azalan adiponektin sekresyonu ve HIV proteaz inhibitörleri ile bağlantılı interlökin-6'nın indüklenmiş ekspresyonu da insülin ile uyarılan glukoz alımının inhibisyonuna katkıda bulunabilir.
Tasarım
Proteaz inhibitörleri , proteazın gerçek substratlarının geçiş durumunu taklit edecek şekilde tasarlanmıştır . Bir peptid bağı -NH-CO- oluşan hidroksıetilen grubu ile değiştirildiği (-CH 2 -CH (OH) -), proteaz klivaj mümkün olan. HIV proteaz inhibitörleri , HIV aspartik proteazın aktif bölgesine uyar ve aspartil proteazın etki tarzına ilişkin bilgi kullanılarak rasyonel olarak tasarlanmıştır . En umut verici geçiş durumu taklidi, ilk proteaz inhibitörü sakinavirin keşfine yol açan hidroksietilamindi . Bu keşfin ardından, diğer HIV proteaz inhibitörleri aynı prensip kullanılarak tasarlandı.
bağlama sitesi
HIV proteaz, iki 99 amino asit monomerinden oluşan bir C2-simetrik homodimerik enzimdir . Her monomer , kataliz için gerekli olan Asp-25 ve Asp-25´ bir aspartik asit kalıntısına katkıda bulunur . HIV proteazı, diğer memeli aspartik proteaz enzimleri arasında korunan Asp- Thr - Gly dizisine sahiptir . Monomerler üzerinde kanat olarak bilinen uzatılmış bir beta-tabaka bölgesi, hidrofobik bir boşluğun altında yatan iki aspartil tortusu ile kısmen substrat bağlama bölgesini oluşturur . Her esnek kanatçık üç karakteristik bölge içerir: dışa doğru uzanan yan zincirler ( Met 46, Phe 53), içe doğru uzanan hidrofobik zincirler ( Ile 47, Ile54) ve glisin açısından zengin bölge (Gly48, 49, 51, 52). Ile50, dönüşün ucunda kalır ve enzim bağlanmadığında bir su molekülü , her monomer üzerinde Ile50'nin omurgasına hidrojen bağları yapar .
HIV proteazları , yüksek dizi seçiciliği ve katalitik yeterlilik ile peptit bağlarının hidrolizini katalize eder . HIV proteazın mekanizması, bu enzimin tam ayrıntılı mekanizması tam olarak anlaşılmamış olsa da, aspartik proteaz ailesinin geri kalanıyla birçok özelliği paylaşır. Su molekülü, kanatçıkların açılıp kapanmasında ve enzim ile substrat arasındaki afiniteyi arttırmada rol oynuyor gibi görünmektedir. Aspartil kalıntıları, peptit bağlarının hidrolizinde yer alır. Bu enzim için tercih edilen bölünme bölgesi , özellikle fenilalanin ve prolin veya tirozin ve prolin arasındaki prolin kalıntılarının N-terminal tarafıdır .
Gelişim
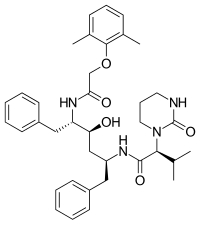
İlk HIV proteaz inhibitörü sakinavir, bir peptidomimetik hidroksietilamindir ve 1995'te pazarlanmıştır. Proteazın doğal bir substratının bir geçiş durumu analoğudur . HIV-1 proteazının Tyr-Pro veya Phe-Pro dipeptitlerini içeren dizileri parçaladığı gözlemi, temel tasarım kriteriydi. Eklenmesi dekahidroizokinolin (DIQ) grubu saquinavir keşfine yol açan en önemli değişiklikler oldu. Bu ikame edici, inhibitörün konformasyonel serbestliğini sınırlayarak suda çözünürlüğü ve gücü iyileştirir. Sakinavir hem HIV-1 hem de HIV-2'ye karşı etkilidir ve genellikle iyi tolere edilir ancak yüksek serum konsantrasyonuna ulaşılmaz.
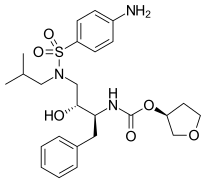
Bir peptidomimetik HIV proteaz inhibitörü olan Ritonavir , 1996'da pazarlanmıştır. Proteazın bağlanma bölgesindeki C2 simetrisine uyacak şekilde tasarlanmıştır. Ritonavir'in geliştiricileri Abbott Laboratories , virüse karşı aktif olan ancak biyoyararlanımı zayıf olan bileşiklerle işe başladı . Bazı iyileştirmeler yapıldı, örneğin terminal fenil kalıntıları çıkarıldı ve suda çözünürlük eklemek için piridil grupları yerleştirildi. Bu iyileştirmelerin son ürünü ritonavir oldu. Önemli gastrointestinal yan etkiler ve büyük hap yükü, ritonavirin ana dezavantajlarıdır ve bu nedenle tek bir tedavi olarak kullanılmaz. Bununla birlikte, sitokrom P450 enzim aracılı metabolizmanın güçlü bir inhibitörüdür ve sadece farmakokinetik güçlendirme için diğer proteaz inhibitörleri ile kombinasyon terapisinde kullanılır.
Bir peptidomimetik hidroksietilen HIV proteaz inhibitörü olan indinavir, piyasaya 1996 yılında ulaştı. İndinavir'in tasarımı, moleküler modelleme ve inhibe edilen enzim kompleksinin X-ışını kristal yapısı tarafından yönlendirildi . Terminal fenil bileşenleri, gücü artırmak için hidrofobik bağlanmaya katkıda bulunur . HIV Gag-poliproteininin fenilalanin-prolin bölünme bölgesinin bir analogudur.
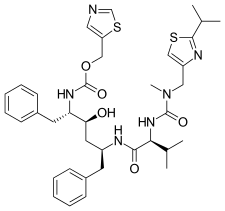
Nelfinavir , peptidomimetik olmayan ilk proteaz inhibitörüydü. Oral olarak biyoyararlanımı olan ve peptidik olmayan bir inhibitör olan nelfinavir'in tasarım sürecinde, peptidik inhibitörlerin yinelemeli protein kokkristal yapı analizi kullanılmış ve inhibitörlerin parçaları, peptidik olmayan ikame ediciler ile değiştirilmiştir. Nelfinavir yeni bir 2-metil-3-hidroksibenzamid grubu içerirken karboksil terminali sakinavir ile aynı DIQ grubunu içerir. Nelfinavir 1997'de piyasaya sürüldü ve pediatrik AIDS için endike olan ilk proteaz inhibitörüydü .
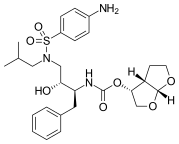
Amprenavir, 1999'da pazara ulaştı. Bir N , N- değiştirilmiş amino- sülfonamid peptit olmayan HIV proteaz inhibitörüdür ve önceki proteaz inhibitörleriyle bazı ortak özellikleri paylaşır. Sakinavire benzer bir çekirdeğe sahiptir, ancak her iki ucunda farklı fonksiyonel gruplar bulunur. Bir ucunda bir tetrahidrofuran karbamat grubuna sahiptir ve diğer ucunda bir amid eklenmiş bir izobütilfenil sülfonamiddir. Bu yapı, daha az kiral merkezle sonuçlanır , bu da sentezlemeyi kolaylaştırır ve ona suda çözünürlüğü arttırır. Bu da daha iyi oral biyoyararlanım sağlar. Ancak amprenavir, ön ilacı olan fosamprenavir'in birçok yönden üstün olduğunu kanıtladığı için 2004 yılında piyasadan çekilmiştir .
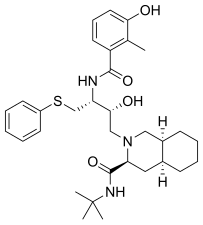
Lopinavir 2000 pazarlanan ve ilk olarak inhibitör ile etkileşimlerini azaltmak için tasarlanmıştır Val , HIV-1 proteaz için 82, genellikle bir tortu mutasyona uğramış içinde ilaca dirençli suşların virüs. Bir peptidomimetik HIV proteaz inhibitörüdür ve çekirdeği ritonavirinkiyle aynıdır. Ritonavirdeki 5- tiyazolil uç grubu yerine , lopinavir bir fenoksiasetil grubuna sahiptir ve ritonavirdeki 2-izopropiltiazolil grubu, amino terminaline altı üyeli bir siklik üre eklenmiş modifiye bir valin ile değiştirilmiştir .
Fosamprenavir 2003 yılında pazarlanmıştır ve hızlı ve kapsamlı bir şekilde amprenavire metabolize olan bir fosfoester ön ilacıdır. Çözünürlüğü ve biyoyararlanımı amprenavirden daha iyidir ve bu da günlük hap yükünün azalmasına neden olur.
Atazanavir , 2003 yılında pazarlanmıştır ve enzim bağlama bölgesinin C2 simetrisine uyacak şekilde tasarlanmış bir azapeptit proteaz inhibitörüdür. Atazanavir, önceki HIV proteaz inhibitörlerinden daha iyi dirençli profiller göstermiştir. Sadece asidik bir ortamda emilebildiği için diğer proteaz inhibitörleri arasında benzersizdir .
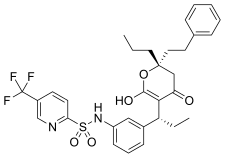
Tipranavir , peptidik olmayan bir HIV-1 proteaz inhibitörüdür ve piyasaya 2005 yılında ulaşmıştır. Piyasadaki diğer HIV proteaz inhibitörlerinden farklı olarak, tipranavir, peptidik olmayan bir kumarin şablonundan geliştirilmiştir ve antiproteaz aktivitesi, yüksek verimli tarama ile keşfedilmiştir . 5,6-dihidro-4-hidroksi-2-piron içeren bu sülfonamid, 3-ikameli kumarinler ve dihidropironların taranmasından ortaya çıkmıştır. Çoklu proteaz inhibitörüne dirençli HIV-1'e karşı geniş antiviral aktiviteye sahiptir.
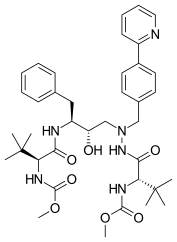
Darunavir pazara 2006 yılında ulaştı ve terminal tetrahidrofuran (THF) grubunda kritik bir değişiklikle amprenavirin peptidik olmayan bir analoğudur. Darunavir, tek bir THF grubu yerine, onu amprenavirden daha etkili kılan bir bis-THF kısmı oluşturmak üzere bileşikte kaynaşmış iki THF grubu içerir . Bu yapısal değişiklikle, bis-THF kısmı etrafındaki stereokimya , amprenavir için bir direnç geliştiren proteaz ile sürekli bağlanmaya izin veren oryantasyonel değişiklikler sağlar.
FDA onaylı tüm proteaz inhibitörleri aşağıda listelenmiştir.

|
|
|
|
| sakinavir | Nelfinavir | ritonavir | lopinavir |
|

|
|
|
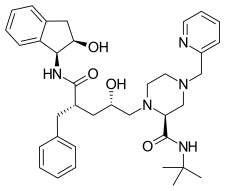
| Amprenavir | Fosamprenavir | Darunavir | |
|
|
|
|
| indinavir | Atazanavir | Tipranavir |
Yapı-aktivite ilişkisi

Piyasadaki tüm HIV proteaz inhibitörleri, bir kumarin iskelesine dayanan tipranavir'in merkezi çekirdeği olmanın tek istisnası dışında, bir hidroksietilen yapı iskelesinden oluşan bir merkezi çekirdek motifi içerir. HIV proteaz inhibitörleri üzerindeki çok önemli bir grup, bağlanma bölgesindeki Asp-25 ve Asp-25´ kalıntıları üzerindeki karboksilik asit ile bir hidrojen bağı oluşturan çekirdek motif üzerindeki bir hidroksil grubudur . Ile50 ve Ile50' ile bağlantılı su molekülü ile peptidomimetik inhibitörlerin karbonil grupları arasındaki hidrojen bağları, onları flep bölgelerine bağlar gibi görünmektedir. Öte yandan, peptid olmayan inhibitörleri, yerini bir proton kabul vardır tetracoordinated su molekülü ve enzimin kanat iki Ile50 kalıntıları ile direkt olarak etkileşime girer. Genellikle S1, S1', S2 ve S2' olarak adlandırılan HIV proteazının bağlanma bölgesindeki spesifik cepler, doğal substratlar üzerindeki hidrofobik amino asitleri tanır. Bu alanları tamamlayan hidrofobik gruplar taşıyan inhibitörlerin gücü bu nedenle artar. Enzim bağlama bölgesindeki bazı kalıntılar, örneğin amprenavir ve darunavir üzerindeki THF kısımları gibi inhibitör üzerindeki hidrofilik gruplarla hidrojen bağları oluşturabilir. Darunavir, amprenavir'deki gibi tek bir THF parçası yerine bir bis-THF parçasına sahip olduğundan, daha fazla hidrojen bağı oluşturabilir ve bağlanma enerjisini artırabilir .
Direnç
Konformasyonel şekildeki değişiklikleri kodlayan mutasyonlar, HIV'in proteaz inhibitörlerine karşı direncini kolaylaştırır. Bu mutasyonların yerleri, Gag-Pol poliprotein öncülerindeki proteaz bölünme bölgelerindekiler de dahil olmak üzere, öncelikle HIV proteaz enziminin aktif bölgesinde ve ayrıca aktif bölgenin dışındadır. Bölünme bölgeleri oldukça çeşitli dizilere sahiptir, bu nedenle proteaz, substratlarını diziye dayalı olarak değil, aktif bölgeye bağlandığında substratların paylaştığı korunan 3D şekli tanır. Bu korunmuş şekil, alt tabaka zarfı olarak adlandırılmıştır . Aktif bölge mutasyonlarının, inhibitörlerin etkileşimlerini doğrudan değiştirdiği ve çoğunlukla inhibitörlerin substrat zarfının ötesindeki proteaz kalıntılarıyla temas ettiği pozisyonlarda meydana geldiği gösterilmiştir. Aktif olmayan site mutasyonlarının, dimer stabilitesini ve konformasyonel esnekliği etkilemek gibi diğer mekanizmalardan etkilendiği düşünülmektedir .
En az 26'sı proteaz inhibitörlerine özgü olan 100'ün üzerinde tek gen noktası mutasyonu tanımlanmıştır. Bunlardan, ilaç aktivitesini değiştirmeye yetecek kadar önemli olan yaklaşık 15 birincil veya büyük mutasyon vardır. HIV-1 proteazında ilaç direncine neden olan birçok mutasyona uğramış kalıntı bulunmuştur, örneğin Leu33'ün Ile, Val veya Phe'deki değişiklikleri; Val82'den Ala , Phe, Leu veya Thr'ye ; Ile84'ten Val'e; ve Leu90'dan Met'e. Farklı mutasyonlar, farklı proteaz inhibitörlerini etkiler. Örneğin, Leu90'daki mutasyonlar sakinavir ve nelfinavir'i açıkça etkilerken indinavir aktivitesi Met46, Val82 ve Ile84'teki mutasyonlardan etkilenir ve Ile50 Val ve Ile84'e değiştiğinde fosamprenavir etkilenir. Mutasyonların bir kombinasyonu, yüksek düzeyde ilaç direnci sağlayabilir, ancak tekli mutasyonlar normalde proteaz inhibitörlerine karşı ilaç direnci ile eşitlenmez. Mutasyonlar, birincil mutasyonlar ve ikincil mutasyonlar olarak ikiye ayrılabilir. Birincil mutasyonlar genellikle direnç üzerinde sadece küçük bir etkiye sahiptir. Çoğu proteaz inhibitörünün kimyasal yapıları oldukça benzerdir, bu nedenle bazı birincil mutasyonların aynı anda çoklu proteaz inhibitörlerine karşı dirence yol açması şaşırtıcı değildir. Çapraz direnç , proteaz inhibitörü tedavisinin en büyük sorunlarından biridir. Sürekli proteaz inhibitörü tedavisi sırasında proteazda ortaya çıkan ek mutasyonlara genellikle ikincil mutasyonlar denir. Bu, yüksek düzeyde proteaz inhibitörü direncine yol açabilir.
Stanford HIV RT ve Proteaz Dizisi Veritabanı ("HIV İlaç Direnci Veritabanı" olarak da adlandırılır) 1998'de, iyi karakterize edilmiş antiretroviral tedavi geçmişine sahip kişilerden alınan HIV ters transkriptaz ve proteaz dizileriyle oluşturulmuştur ve direnç mutasyonlarını ve genotipini sorgulamak için halka açıktır. -tedavi, genotip-fenotip ve genotip-sonuç korelasyonları
Substrat zarfı, substratı taklit eden ve çoğu aktif bölge mutasyonunun verdiği direnci önlemek için zarf içinde kalan inhibitörler tasarlamanın genel stratejisini sağlamasına rağmen, özellikle uzak olanlardan dolayı ilaç direnci problemini çözmek için genel bir strateji yoktur. aktif site. AIDS'i iyileştirmek için yeni tedavilerin geliştirilmesine yönelik araştırmalar, halihazırda piyasada bulunan ilaçlara çapraz dirençten kaçınmaya odaklanmıştır.
Şu anki durum
Ocak 2018'de darunavir, pazara ulaşan en yeni HIV proteaz inhibitörüydü.
2006 yılında GlaxoSmithKline , formülasyonla ilgili aşılmaz sorunlar nedeniyle HIV tedavisi için araştırma aşamasında olan bir proteaz inhibitörü olan brecanavirin faz II klinik gelişimini durdurdu .
2009 yazında, GlaxoSmithKline ve Concert Pharmaceuticals, döteryum içeren ilaçları geliştirmek ve ticarileştirmek için işbirliklerini duyurdular . Bunlardan biri, 2009'un ikinci yarısında faz I klinik denemelerine girmesi beklenen HIV tedavisi için bir proteaz inhibitörü olan CTP-518'dir. CTP-518, atazanavir'in belirli anahtar hidrojen atomlarının yerine yeni bir HIV proteaz inhibitörüdür. döteryum. Klinik öncesi çalışmalar, bu modifikasyonun antiviral gücü tamamen koruduğunu, ancak açıkça hepatik metabolizmayı yavaşlatabildiğini ve böylece yarı ömrü ve plazma dip seviyelerini artırabildiğini göstermiştir . Bu nedenle CTP-518, ritonavir gibi bir güçlendirici ajan ile birlikte dozlama ihtiyacını ortadan kaldıran ilk HIV proteaz inhibitörü olma potansiyeline sahiptir.
Ayrıca bakınız
- antiretroviral ilaç
- Ters transkriptaz inhibitörü
- entegreaz inhibitörü
- giriş inhibitörü
- Nükleosid olmayan ters transkriptaz inhibitörlerinin keşfi ve geliştirilmesi


