Kinetik izotop etkisi - Kinetic isotope effect
Reaksiyonunda metil bromür ile siyanür ,
karbon kinetik izotop etkisi metil grubu 1.082 ± 0.008 olduğu bulunmuştur.
İçinde fiziksel organik kimya , bir kinetik izotop etkisi ( KİE ) değişimdir reaksiyon hızı a kimyasal reaksiyonun bir zaman atomuna içinde reaktiflerin barındırmayan biriyle değiştirilir izotoplar . Biçimsel olarak, hafif ( k L ) ve ağır ( k H ) izotopik olarak sübstitüe edilmiş reaktanları (izotopologlar) içeren reaksiyonlar için hız sabitlerinin oranıdır :
Reaksiyon hızındaki bu değişiklik, öncelikle daha hafif muadillerine kıyasla daha düşük titreşim frekanslarına sahip olan daha ağır izotopologlardan kaynaklanan kuantum mekanik bir etkidir . Çoğu durumda, bu, daha ağır izotopologların geçiş durumuna (veya nadir durumlarda, ayrışma sınırına ) ulaşması için gereken daha büyük bir enerji girdisi ve sonuç olarak daha yavaş bir reaksiyon hızı anlamına gelir. Kinetik izotop etkilerinin incelenmesi, belirli kimyasal reaksiyonların reaksiyon mekanizmasının aydınlatılmasına yardımcı olabilir ve bazen ilaç geliştirmede metabolik olarak hassas CH bağlarını koruyarak elverişsiz farmakokinetiği iyileştirmek için kullanılır .
Arka fon
Kinetik izotop etkisi, reaksiyon mekanizmalarının incelenmesi için en temel ve hassas araçlardan biri olarak kabul edilir , bilgisi karşılık gelen reaksiyonların istenen niteliklerinin iyileştirilmesine izin verir. Örneğin, kinetik izotop etkileri, bir nükleofilik ikame reaksiyonunun tek moleküllü (S N 1) veya bimoleküler (S N 2) bir yol izleyip izlemediğini ortaya çıkarmak için kullanılabilir .
Metil bromür ve siyanürün reaksiyonunda ( girişte gösterilmiştir), gözlemlenen metil karbon kinetik izotop etkisi, bir S N2 mekanizmasını gösterir. Yolunun bağlı olarak, farklı stratejiler stabilize etmek için kullanılabilir geçiş durumunu ve hız belirleyici adım reaksiyonunun geliştirmek ve reaksiyon hızını endüstriyel uygulamalar için önemlidir ve seçicilik.
Etki, etkilenen bağların titreşim frekansları ile ilgili olduğundan, izotopik hız değişiklikleri en çok bağıl kütle değişimi en büyük olduğunda belirgindir . Örneğin, bir hidrojen atomunu (H) izotop döteryumuna (D) değiştirmek, kütlede %100'lük bir artışı temsil ederken, karbon -12'yi karbon-13 ile değiştirmek , kütle sadece yüzde 8 artar. Bir C-H bağı içeren bir reaksiyonun hızı tipik olarak karşılık gelen C-D bağından 6-10 kat daha hızlıyken, 12 C reaksiyonu karşılık gelen 13 C reaksiyonundan sadece yüzde 4 daha hızlıdır (her iki durumda da, izotop bir atomik kütle birimi daha ağırdır).
İzotopik ikame, reaksiyon hızını çeşitli şekillerde değiştirebilir. Bir çok durumda, oran farkı, bir atom kütlesi etkilediğini belirterek rasyonalize edilebilir titreşim frekansı arasında kimyasal bir bağ , hatta eğer oluşturan potansiyel enerji yüzey reaksiyonu için hemen hemen aynıdır. Daha ağır izotoplar ( klasik olarak ) daha düşük titreşim frekanslarına yol açacaktır veya kuantum mekaniksel olarak bakıldığında daha düşük sıfır noktası enerjisine sahip olacaktır . Daha düşük bir sıfır noktası enerjisiyle, bağı kırmak için daha fazla enerji sağlanmalıdır, bu da bağ bölünmesi için daha yüksek bir aktivasyon enerjisi ile sonuçlanır ve bu da ölçülen oranı düşürür (örneğin, Arrhenius denklemine bakınız ).
sınıflandırma
Birincil kinetik izotop etkileri
Bir birincil kinetik izotop etkisi , izotopik olarak etiketlenmiş atomuna bir bağ oluşturduğu ya da kırılmış edilirken bulunabilir. Bu arada bağlı olarak, bir kinetik izotop etkisi (oranlarının paralel ölçüm incelenir vs arası rekabet genel molekül içi rekabet), bir birincil kinetik izotop etkisi gözlenmesi hız sınırlayıcı bir aşama olarak izotop, bir bağ oluşturan / kırılma göstergesidir veya sonraki ürün belirleme adım(lar)ı. (Birincil kinetik izotop etkisinin, hız sınırlama adımında izotopa bağ bölünmesini/oluşumunu yansıtması gerektiği yanılgısı, ders kitaplarında ve birincil literatürde sıklıkla tekrarlanır: aşağıdaki deneylerle ilgili bölüme bakın. )
Daha önce bahsedilen nükleofilik ikame reaksiyonları için, birincil kinetik izotop etkileri, hem ayrılan gruplar, nükleofiller hem de ikamenin meydana geldiği a-karbon için araştırılmıştır. Ayrılan grup kinetik izotop etkilerinin yorumlanması, sıcaklıktan bağımsız faktörlerin önemli katkılarından dolayı ilk başta zor olmuştur. Α-karbondaki kinetik izotop etkisi S geçiş safhasında simetri bazı anlayış geliştirmek için kullanılabilir , N , bu kinetik izotop etkisi nedeniyle olmayan titreşim katkısı da, ideal olacaktır olandan daha az hassastır, ancak, 2 reaksiyonlarında faktörler.
İkincil kinetik izotop etkileri
Bir ikinci kinetik izotop etkisi tepkime maddesi olarak izotopik olarak etiketlenmiş atomuna bir bağ kırılması veya oluşturulduğu zaman görülmektedir. İkincil kinetik izotop etkileri, birincil kinetik izotop etkilerinden çok daha küçük olma eğilimindedir; bununla birlikte, ikincil döteryum izotop etkileri, döteryum atomu başına 1.4 kadar büyük olabilir ve ağır element izotop etkilerini çok yüksek hassasiyetle ölçmek için teknikler geliştirilmiştir, bu nedenle ikincil kinetik izotop etkileri, reaksiyon mekanizmalarını aydınlatmak için hala çok faydalıdır.
Yukarıda bahsedilen nükleofilik sübstitüsyon reaksiyonları için, α-karbon ikincil hidrojen kinetik izotop etkisi S ayırt doğrudan yol sağlar N 1 S , N 2 reaksiyonları. S olduğu bulunmuştur K G ise 1 reaksiyonlar tipik olarak, yaklaşık 1.22 ile teorik maksimum yaklaşırken, geniş orta kinetik izotop etkilere yol K 2 reaksiyonlar tipik olarak, çok yakın ya da daha az birden daha birincil kinetik izotop etkileri verir. 1'den büyük olan kinetik izotop etkileri , normal kinetik izotop etkileri olarak adlandırılırken, birden az olan kinetik izotop etkileri , ters kinetik izotop etkileri olarak adlandırılır . Genel olarak, geçiş durumundaki daha küçük kuvvet sabitlerinin normal bir kinetik izotop etkisi vermesi beklenir ve geçiş durumundaki daha büyük kuvvet sabitlerinin, germe titreşimi katkıları kinetik izotop etkisine hakim olduğunda ters bir kinetik izotop etkisi vermesi beklenir.
Α-karbon tür ikincil izotop etkileri büyüklükleri ölçüde Cı belirlenir α -H (D) titreşim. S için K karbon bir sp dönüştürülür yana 1 reaksiyon, 2 ° C de bir artış ile hız belirleyici aşaması için geçiş durumu sırasında hibritlenmiş karbenyum iyonu α -H (D), bir bağ için, bir ters kinetik izotop etkisi olacaktır sadece germe titreşimleri önemli olsaydı beklenirdi. Gözlenen büyük normal kinetik izotop etkilerinin, reaktanlardan karbenyum oluşumunun geçiş durumuna geçerken önemli düzlem dışı bükülme titreşim katkılarından kaynaklandığı bulunmuştur. S için K 2 reaksiyonları, eğilme titreşimleri hala kinetik izotop etkisi için önemli bir rol oynar, ancak, germe titreşim katılım daha karşılaştırılabilir büyüklüktedir, ve elde edilen kinetik izotop etkisi, normal veya ilgili titreşim belirli katkılar bağlı olarak ters olabilir.
teori
İzotop etkilerinin teorik olarak ele alınması, büyük ölçüde , reaksiyon için tek bir potansiyel enerji yüzeyi ve reaktanlar ile bu yüzeydeki ürünler arasında, üzerinde geçiş durumunun bulunduğu bir bariyer varsayan geçiş durumu teorisine dayanır . Kinetik izotop etkisi, büyük ölçüde, potansiyel enerji yüzeyinin minimum enerji yolu boyunca izotopik pertürbasyon tarafından üretilen titreşimsel zemin durumlarındaki değişikliklerden kaynaklanır ve bu, yalnızca sistemin kuantum mekanik işlemleriyle açıklanabilir. Reaksiyon koordinatı boyunca hareket eden atomun kütlesine ve enerji bariyerinin doğasına (genişlik ve yükseklik) bağlı olarak, kuantum mekaniksel tünelleme ayrıca gözlemlenen bir kinetik izotop etkisine büyük katkı sağlayabilir ve ayrıca ayrıca dikkate alınması gerekebilir. "yarı-klasik" geçiş durumu teorisi modeline.
Döteryum kinetik izotop etkisi ( 2 H KIE), açık farkla en yaygın, kullanışlı ve iyi anlaşılmış kinetik izotop etkisi türüdür. Yoğunluk fonksiyonel teori hesaplamaları kullanılarak bir döteryum kinetik izotop etkisinin sayısal değerinin doğru tahmini artık nispeten rutindir. Ayrıca, birkaç nitel ve yarı nicel model, döteryum izotop etkilerinin kaba tahminlerinin hesaplamalar olmadan yapılmasına izin verir, çoğu zaman deneysel verileri rasyonelleştirmek için yeterli bilgi sağlar ve hatta farklı mekanik olasılıkları destekler veya çürütür. Döteryum içeren başlangıç malzemeleri genellikle ticari olarak temin edilebilir, bu da izotopik olarak zenginleştirilmiş başlangıç malzemelerinin sentezini nispeten basit hale getirir. Ayrıca, döteryum ve protiyum kütlesindeki büyük nispi fark ve buna eşlik eden titreşim frekanslarındaki farklılıklar nedeniyle, izotop etkisinin büyüklüğü, protium ve trityum hariç diğer izotop çiftlerinden daha büyüktür ve hem birincil hem de ikincil izotop etkilerine izin verir. kolayca ölçülebilir ve yorumlanabilir. Buna karşılık, ikincil etkiler genellikle daha ağır elementler için çok küçüktür ve büyüklük olarak deneysel belirsizliğe yakındır, bu da yorumlarını karmaşıklaştırır ve faydalarını sınırlar. İzotop etkileri bağlamında, hidrojen , özellikle hafif izotop protium'u ( 1 H) belirtmek için sıklıkla kullanılır . Bu makalenin geri kalanında, paralel gramer yapılarında hidrojen ve döteryuma atıfta bulunulması veya bunlar arasındaki doğrudan karşılaştırmalar, protium ve döteryuma atıfta bulunuluyor olarak yorumlanmalıdır.
Kinetik izotop etkileri teorisi ilk olarak 1949'da Jacob Bigeleisen tarafından formüle edilmiştir . Bigeleisen'in döteryum kinetik izotop etkileri (daha ağır elementlere de uygulanabilir) için genel formülü aşağıda verilmiştir. Hız sabitleri k H ve k D' nin hesaplanması için geçiş durumu teorisini ve öteleme, dönme ve titreşim seviyelerinin istatistiksel mekanik işlemlerini kullanır . Bununla birlikte, bu formül "yarı klasiktir", çünkü genellikle ayrı bir düzeltme faktörü olarak sunulan kuantum tünellemenin katkısını ihmal eder. Bigeleisen'in formülü aynı zamanda, bir C-H bağına kıyasla biraz daha kısa C-D bağının neden olduğu bağlanmamış itme etkileşimlerindeki farklılıklarla da ilgilenmez. Denklemde, H veya D alt simgeli miktarlar sırasıyla hidrojen veya döteryum ikameli türlere atıfta bulunurken, çift hançerli veya onsuz miktarlar, ‡, sırasıyla geçiş durumunu veya reaktan temel durumunu belirtir. (Kesinlikle söylemek gerekirse, iletim katsayılarındaki izotopik farklılıktan kaynaklanan bir terim de dahil edilmelidir.)
- ,
nerede tanımlıyoruz
- ve .
Burada, h olan Planck sabiti , k, B ise Boltzmann sabiti , ifade titreşim, frekansı dalga sayısı , C olan ışık hızı , K A olduğu avagadro ve R, bir evrensel gaz sabiti . σ X (X = H veya D), reaktanlar ve geçiş durumları için simetri sayılarıdır. E X karşılık gelen türlerin moleküler kütleleri, ve I q X, ( q = x , y , ya da Z ) terimleri üç ana eksenleri etrafında atalet momentleri bulunmaktadır. U ı X karşılık gelen titreşim frekanslarına, doğrudan orantılıdır ν i ve titreşim sıfır nokta enerjisi (aşağıya bakınız). N ve N ‡ tam sayıları , sırasıyla reaktanlardaki ve geçiş durumlarındaki atomların sayısıdır. Yukarıda verilen karmaşık ifade, dört ayrı faktörün ürünü olarak gösterilebilir:
- .
Döteryum izotop etkilerinin özel durumu için, ilk üç terimin birliğe eşit veya birlikle iyi yaklaşık olarak ele alınabileceğini tartışacağız. İlk faktör S (σ X içeren ), çeşitli türler için simetri sayılarının oranıdır. Bu, reaktanlarda ve geçiş durumunda özdeş atomların veya grupların permütasyonuna yol açan moleküler ve bağ dönüşlerinin sayısına bağlı olan bir rasyonel sayı (tam sayıların oranı) olacaktır. Düşük simetrili sistemler için, tüm σ X (reaktan ve geçiş durumu) birlik olacaktır; bu nedenle S genellikle ihmal edilebilir. MMI (ihtiva eden bir faktör E X ve I q X ) moleküler kütle oranına ve atalet momentleri belirtmektedir. Hidrojen ve döteryum, çoğu reaktan ve geçiş durumuna kıyasla çok daha hafif olma eğiliminde olduğundan, H ve D içeren moleküller arasında moleküler kütleler ve atalet momentlerinde çok az fark vardır, bu nedenle MMI faktörü de genellikle birlik olarak yaklaşık olarak kabul edilir. EXC (titreşim ürünü içeren faktör bölme işlevleri ) titreşimli uyarılmış moleküllerin reaksiyonların neden kinetik izotop etkisi için düzeltir. Uyarılmış durum A–H/D bağ titreşimlerine sahip olmak için yeterli enerjiye sahip moleküllerin oranı, oda sıcaklığında veya buna yakın reaksiyonlar için genellikle küçüktür (hidrojene bağlar genellikle 1000 cm- 1 veya daha yüksekte titreşir , bu nedenle exp(- u i ) = exp(- hν i / k B T ) 298 K'da < 0.01, 1–exp(- u i ) faktörlerinin ihmal edilebilir katkılarıyla sonuçlanır ). Bu nedenle, hidrojen/döteryum kinetik izotop etkileri için, gözlemlenen değerlere tipik olarak son faktör, ZPE (titreşimsel sıfır noktası enerji farklarının üstel bir fonksiyonu) hakimdir; bu , titreşimlerin her biri için sıfır noktası enerji farklarından katkılardan oluşur. aşağıdaki gibi temsil edilebilen reaktanların ve geçiş durumunun modları:
- ,
nerede tanımlıyoruz
- ve .
İkinci ifadenin üssündeki toplamlar, reaktant temel durumunun ve geçiş durumunun tüm titreşim modları üzerinden geçtiği şeklinde yorumlanabilir. Alternatif olarak, bunlar, reaktant veya geçiş durumuna özgü modlar üzerinden veya reaksiyon koordinatı boyunca ilerleme üzerine büyük ölçüde değişen titreşim frekansları olarak yorumlanabilir. Geri kalan reaktant ve geçiş durumu titreşim modları çiftleri çok benzerdir ve üsteki toplamlar hesaplandığında iptaller meydana gelir. Bu nedenle, pratikte, döteryum KIE'leri, bu iptal nedeniyle genellikle bir avuç kilit titreşim moduna bağlıdır ve k H / k D'nin kalitatif analizlerini mümkün kılar.
Belirtildiği gibi, özellikle hidrojen/döteryum ikamesi için, çoğu kinetik izotop etkisi , reaktanlar ve söz konusu izotopologların geçiş durumu arasındaki sıfır noktası enerjisindeki (ZPE) farktan kaynaklanır ve bu fark, aşağıdaki açıklama ile niteliksel olarak anlaşılabilir. : Born-Oppenheimer yaklaşımı içinde , potansiyel enerji yüzeyi her iki izotop türü için aynıdır. Bununla birlikte, enerjinin kuantum-mekanik bir muamelesi, bu eğriye ayrık titreşim seviyeleri getirir ve bir molekülün mümkün olan en düşük enerji durumu, enerjide potansiyel enerji eğrisinin minimumundan biraz daha yüksek olan en düşük titreşim enerji seviyesine karşılık gelir. Sıfır noktası enerjisi olarak adlandırılan bu fark, CH veya CD bağ uzunluğunda bir belirsizliği gerektiren Heisenberg belirsizlik ilkesinin bir tezahürüdür. Daha ağır türler (bu durumda döteryumlu türler) daha "klasik" davrandığından, titreşim enerji seviyeleri klasik potansiyel enerji eğrisine daha yakındır ve daha düşük bir sıfır noktası enerjisine sahiptir. İki izotopik tür arasındaki sıfır noktası enerji farkları, en azından çoğu durumda, bağ kopması sırasında bağ kuvveti sabiti azaldığından geçiş durumunda azalır. Bu nedenle, döteryumlu türlerin düşük sıfır noktası enerjisi, aşağıdaki şekilde gösterildiği gibi reaksiyonu için daha büyük bir aktivasyon enerjisine dönüşür ve normal bir kinetik izotop etkisine yol açar. Bu etki, prensipte, başlangıç malzemesi için tüm 3 N− 6 titreşim modunu ve geçiş durumunda 3 N ‡ − 7 titreşim modunu hesaba katmalıdır (bir mod, reaksiyon koordinatına karşılık gelen mod eksiktir. geçiş durumu, çünkü bir bağ kırılır ve harekete karşı onarıcı bir kuvvet yoktur). Harmonik osilatör en azından düşük enerjili titreşim durumları için, titreşimli bir bağ için iyi bir tahmindir. Kuantum mekaniği, titreşimsel sıfır noktası enerjisini olarak verir . Bu nedenle, yukarıdaki basitleştirilmiş formülün üssünde ½ faktörünü ve temel durum ve geçiş durumu titreşim modları üzerinden terimlerin toplamını kolayca yorumlayabiliriz . Bir harmonik osilatör için, titreşim frekansı, titreşen sistemin azaltılmış kütlesinin karekökü ile ters orantılıdır:
- ,
burada k, f olan kuvvet sabiti . Ayrıca, indirgenmiş kütle, sistemin hafif atomunun kütlesi ile yaklaşık olarak hesaplanır, X = H veya D. m D yaklaşık 2 m H olduğundan ,
- .
Homolitik bir C–H/D bağ ayrışması durumunda, geçiş durumu terimi kaybolur ve diğer titreşim modları ihmal edilir, k H / k D = exp(½Δ u i ). Böylece, daha sert ("daha güçlü") bir C–H/D bağı için daha büyük bir izotop etkisi gözlenir. İlgilenilen reaksiyonların çoğu için, iki atom arasında bir hidrojen atomu transfer edilir, geçiş durumu [A···H···B] ‡ ve geçiş durumundaki titreşim modlarının hesaba katılması gerekir. Bununla birlikte, daha yüksek bir titreşim frekansına sahip bir bağın bölünmesinin daha büyük bir izotop etkisi vereceği hala genel olarak doğrudur.

Tünel açmayan bir döteryum KIE için olası maksimum değeri hesaplamak için, tipik bir karbon-hidrojen bağının (3000 cm- 1 ) ve karbon-döteryum bağının (2200) gerilme titreşimleri arasındaki sıfır noktası enerji farkının olduğu durumu ele alıyoruz. cm -1 ) geçiş durumunda kaybolur ((1/2)(3000 – 2200 cm- 1 ) = 400 cm -1 veya yaklaşık 1.15 kcal/mol enerji farkı ), sıfır noktası enerjisinden herhangi bir telafi olmaksızın geçiş durumundaki fark (örneğin, geçiş durumuna özgü simetrik A···H···B gerilmesinden). Yukarıda verilen basitleştirilmiş formül, k H / k D için bir maksimumu 6.9 olarak tahmin eder . İki eğilme titreşiminin tamamen kaybolması da dahil edilirse, 15-20 kadar büyük k H / k D değerleri tahmin edilebilir. Bununla birlikte, geçiş durumunda bükülme frekanslarının kaybolması pek olası değildir ve k H / k D değerlerinin oda sıcaklığına yakın 7-8'i aştığı sadece birkaç durum vardır . Ayrıca, bu değerleri aştıkları zaman tünel açmanın önemli bir faktör olduğu sıklıkla bulunur. Değeri k H / K D ~ 10 (298 K çevresinde yer alan reaksiyonlar için bir yarı-klasik primer kinetik izotop etkisi (bir tünel) için formülü maksimum olduğu düşünülmektedir k H / K D bir sıcaklık bağımlılığı vardır, bu nedenle daha düşük sıcaklıklarda daha büyük izotop etkileri mümkündür). H-transferinin geçiş durumunun doğasına bağlı olarak (simetrik veya "erken" veya "geç" ve doğrusal veya bükülmüş), birincil döteryum izotop etkisinin bu maksimuma yaklaşma derecesi değişir. Westheimer tarafından geliştirilen bir model , simetrik (Termonötr, Hammond Postulate tarafından ), doğrusal geçiş durumlarının en büyük izotop etkilerine sahip olduğunu, geçiş durumlarının ise "erken" veya "geç" (sırasıyla ekzotermik veya endotermik reaksiyonlar için) veya doğrusal olmayan olduğunu öngörmüştür. (örn. döngüsel) daha küçük etkiler gösterir. Bu tahminler o zamandan beri kapsamlı deneysel destek aldı.
İkincil döteryum izotop etkileri için, Streitwieser , reaktant temel durumundan geçiş durumuna eğilme modlarının zayıflamasının (veya ters izotop etkisi durumunda güçlendirilmesinin) gözlemlenen izotop etkilerinden büyük ölçüde sorumlu olduğunu öne sürdü. Bu değişiklikler, H/D'ye bağlanan karbonun sp 3'ten sp 2'ye yeniden hibridizasyona uğradığı veya bunun tersi (bir α ikincil kinetik izotop etkisi) olduğunda sterik ortamdaki bir değişikliğe veya bir karbokasyonun olduğu durumlarda hiperkonjugasyon nedeniyle bağın zayıflamasına bağlanır. bir karbon atomu ötede üretiliyor (bir β ikincil kinetik izotop etkisi). Bu izotop etkilerinin teorik maksimumu k H / k D = 2 0,5 ≈ 1,4'tür. Α konumunda ikincil bir kinetik izotop etkisi için sp rehybridization 3 sp 2 sp rehybridization ise, normal bir izotop etkisi üretir 2 sp 3 teorik minimum ters izotop etkisi sonucu k H / K D = 2 -0.5 ≈ 0.7. Uygulamada, k H / k D ~ 1.1-1.2 ve k H /k D ~ 0.8-0.9, α ikincil kinetik izotop etkileri için tipik iken, k H / k D ~ 1.15-1.3, β ikincil kinetik izotop etkisi için tipiktir. Birkaç izotopik olarak sübstitüe edilmiş β-hidrojen atomu içeren reaktanlar için, gözlemlenen izotop etkisi, genellikle, β pozisyonunda uyum içinde hareket eden birkaç H/D'nin sonucudur. Bu durumlarda, izotopik olarak etiketlenmiş her bir atomun etkisi çarpımsaldır ve k H / k D > 2 olduğu durumlar nadir değildir.
Swain denklemi (veya Swain-Schaad-Stivers denklemleri) olarak da bilinen döteryum ve trityum kinetik izotop etkileriyle ilgili aşağıdaki basit ifadeler, bazı sadeleştirmeler kullanılarak yukarıda verilen genel ifadeden türetilebilir:
- ;
yani,
- .
Bu ifadeleri türetirken, indirgenmiş kütlelerin yaklaşık olarak hidrojen, döteryum veya trityum kütlelerine eşit olduğu şeklindeki makul yaklaşım kullanıldı. Ek olarak, titreşim hareketinin bir harmonik osilatör tarafından yaklaşık olduğu varsayılmıştır, böylece (X = H, D veya T). " s " alt simgesi, kuantum tünellemeyi göz ardı eden bu "yarı-klasik" kinetik izotop etkilerini ifade eder. Tünel açma katkıları, bir düzeltme faktörü olarak ayrıca ele alınmalıdır.
Hidrojen dışındaki elementleri içeren izotop etkileri için, bu basitleştirmelerin çoğu geçerli değildir ve izotop etkisinin büyüklüğü, ihmal edilen faktörlerin bazılarına veya tümüne güçlü bir şekilde bağlı olabilir. Bu nedenle, hidrojen dışındaki elementler için kinetik izotop etkilerinin rasyonelleştirilmesi veya yorumlanması genellikle çok daha zordur. Birçok durumda ve özellikle hidrojen transfer reaksiyonları için tünellemeden kaynaklanan kinetik izotop etkilerine katkılar önemlidir (aşağıya bakınız).
tünel açma
Bazı durumlarda, muhtemelen kuantum mekanik tünelleme nedeniyle daha hafif izotop için ek bir hız artışı görülür . Bu tipik olarak yalnızca hidrojen atomlarına bağları içeren reaksiyonlar için gözlenir. Tünelleme, bir molekül potansiyel bir enerji bariyerinin üzerinden değil de içinden geçtiğinde meydana gelir. Klasik mekaniğin yasaları izin vermese de , parçacıklar dalga-parçacık ikiliğine dayanan kuantum mekaniğinde klasik olarak yasaklanmış uzay bölgelerinden geçebilirler .
Tünel açma analizi, bir tünelleme faktörü Q'nun eklenmesini içeren Arrhenius denkleminin Bell'in modifikasyonu kullanılarak yapılabilir :
A, Arrhenius parametresidir, E bariyer yüksekliğidir ve
nerede ve
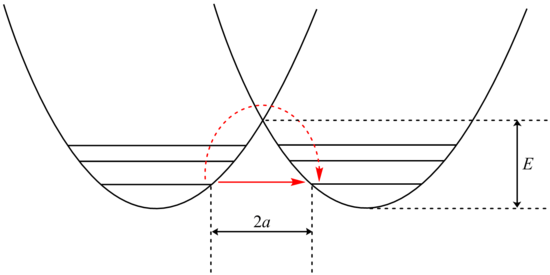
β teriminin incelenmesi , parçacığın kütlesine üstel bağımlılığı gösterir. Sonuç olarak, hidrojen gibi daha hafif bir parçacık için tünelleme çok daha olasıdır. Tünel oluşturan bir protonun kütlesini döteryum izotopuyla değiştirerek basitçe iki katına çıkarmak , bu tür reaksiyonların hızını büyük ölçüde azaltır. Sonuç olarak, sıfır noktası enerjilerindeki farklılıklarla açıklanamayan çok büyük kinetik izotop etkileri gözlemlenir.
Ek olarak, β terimi bariyer genişliği 2a ile lineer olarak bağlıdır. Kütlede olduğu gibi, tünelleme küçük bariyer genişlikleri için en iyisidir. Verici ve alıcı atom arasındaki protonların optimum tünelleme mesafeleri 0,4 Å'dir.
Tünel açma , kinetik değil, dalga mekaniği yasalarına bağlı kuantum mekaniksel bir etkidir . Bu nedenle tünel açma, en küçük kinetik enerji bariyerlerinin bile aşılamadığı ancak tünellerin açılabileceği düşük sıcaklıklarda daha önemli hale gelme eğilimindedir.
Peter S. Zuev ve ark. 1-metilsiklobütilflorokarbenin halka genişlemesi için hız sabitlerinin nitrojende 4.0 x 10 -6 /s ve 8 kelvin'de argonda 4.0 x 10 -5 /s olduğunu bildirdi . 8 kelvin'de, rapor edilen hız sabitinin sıcaklıktan bağımsız olması ve hıza tünelleme katkısının geçiş durumu üzerindeki geçişin katkısından 152 büyüklük mertebesi daha büyük olması için reaksiyonun reaktantın tek bir kuantum durumu yoluyla ilerleyeceğini hesapladılar. enerji bariyeri.
Bu nedenle, sıcaklık düştükçe geleneksel kimyasal reaksiyonların önemli ölçüde yavaşlama eğiliminde olmasına rağmen, tünelleme reaksiyonları nadiren hiç değişir. Bir aktivasyon bariyerinden tünellenen parçacıklar, bir ara türün, reaktantın veya ürünün dalga fonksiyonunun, bir reaksiyonun enerji yüzeyi boyunca belirli bir oluğun enerji kuyusu ile sınırlı olmadığı, ancak "sızabileceği" gerçeğinin doğrudan bir sonucudur. sonraki minimum enerjiye geçer. Bunun ışığında, tünelleme sıcaklıktan bağımsız olmalıdır .
363-463 K sıcaklık aralığında hidrojen atomları tarafından gaz halindeki n-alkanlardan ve sikloalkanlardan hidrojen soyutlaması için, H/D kinetik izotop etkisi verileri , 0.43 ila 0.54 arasında değişen küçük ön- üssel faktör oranları A H / A D ve büyük 9,0 ila 9,7 kJ/mol arasındaki aktivasyon enerjisi farkları. Argümanlarını geçiş durumu teorisine dayandırarak , büyük aktivasyon enerjisi farklılıklarıyla ilişkili küçük A faktör oranları (genellikle C–H(D) bağları için yaklaşık 4,5 kJ/mol) tünelleme için güçlü kanıtlar sağlamıştır. Bu tartışmanın amacı için, kullandıkları çeşitli parafinler için A faktör oranının sıcaklık aralığı boyunca yaklaşık olarak sabit olması önemlidir .
Tünellemenin sıcaklıktan tamamen bağımsız olmadığı gözlemi, belirli bir türün tüm moleküllerinin değişen sıcaklıklarda titreşimsel zemin durumlarını işgal etmemesi gerçeğiyle açıklanabilir. Potansiyel bir enerji kuyusuna termal enerji eklemek, temel durumdan daha yüksek titreşim seviyelerinin doldurulmasına neden olabilir. Kinetik olarak yönlendirilen geleneksel bir reaksiyon için, bu uyarımın hız üzerinde sadece küçük bir etkisi olacaktır. Ancak bir tünelleme reaksiyonu için sıfır noktası enerjisi ile ilk titreşim enerjisi seviyesi arasındaki fark çok büyük olabilir. Tünel açma düzeltme terimi Q , bariyer genişliğine lineer olarak bağlıdır ve Morse potansiyelindeki titreşim modlarının sayısı arttıkça bu genişlik önemli ölçüde azalır . Bariyer genişliğinin azalması tünelleme hızı üzerinde o kadar büyük bir etkiye sahip olabilir ki, küçük bir uyarılmış titreşim durumu popülasyonu bile bu sürece hakim olacaktır.H veya D ile bir reaksiyonun KIE'sinde tünel açmanın dahil olup olmadığını belirlemek için birkaç kriter göz önünde bulundurulur:
- Δ( E a H - E a D ) > Δ( ZPE H - ZPE D ) ( E a =aktivasyon enerjisi; ZPE=sıfır noktası enerjisi)
- Reaksiyon daha düşük sıcaklıklarda devam eder.
- Arrhenius ön üstel faktörler bir D / A , H değildir 1'e eşittir.
- Büyük bir negatif aktivasyon entropisi .
- Tepkimeye girenlerin ve ürünlerin geometrileri genellikle çok benzerdir.
Ayrıca, izotopların H, D ve T'yi içerdiği reaksiyonlar için, bir tünelleme kriteri, H, D veya T'nin değiştirildiği reaksiyonların hız sabitlerini ( k ) karşılaştıran Swain-Schaad ilişkileridir :
- k H / k T =( k D / k T ) X ve k H / k T =( k H / k D ) Y
Organik reaksiyonlarda, bu proton tünelleme etkisi, nitropropanın engellenmiş piridin bazı ile deprotonasyonu ve iyodinasyonu gibi reaksiyonlarda gözlemlenmiştir ve 25 °C'de rapor edilen KIE 25'tir:
ve 1,5 sigmatropik bir hidrojen kaymasında , yüksek sıcaklıklarda elde edilen deneysel değerlerin daha düşük sıcaklıklara çıkarılmasının zor olduğu gözlemlenmesine rağmen:
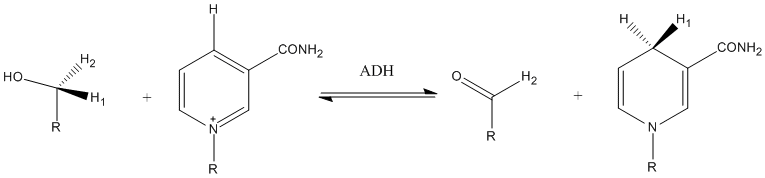
Proton veya hidrit iyon transfer reaksiyonlarında enzim katalizinin yüksek verimliliğinin, kısmen kuantum mekanik tünelleme etkisine bağlı olabileceği uzun süredir tahmin edilmektedir. Bir enzimin aktif bölgesindeki ortam, verici ve alıcı atomu, amino asit yan zincirlerinin, elektrostatik ve kovalent olmayan etkileşimler yoluyla verici ve alıcı atomu birbirine daha yakın "zorlayabildiği" optimal tünel mesafesine yakın konumlandırır. Bir reaksiyon bölgesi içindeki enzimin ve onun olağandışı hidrofobik ortamının tünel açmayı teşvik eden titreşim sağlaması da mümkündür. Ketosteroid izomeraz üzerine yapılan çalışmalar, enzimin katalizli ve enzim katalizli olmayan koşullar altında reaksiyonun birincil ve ikincil kinetik izotop etkilerini karşılaştırarak, enzimin birleşik hareket/hidrojen tünellemesini gerçekten geliştirdiğine dair deneysel kanıtlar sağlamıştır.
KIE tarafından keşfedilen enzim katalizli reaksiyonlarda proton tünellemesi için birçok örnek mevcuttur. İyi çalışılmış bir örnek, proton transfer adımı için 5-55'lik büyük birincil KIE'lerin gözlemlendiği metilamin dehidrojenazdır.

Enzimatik reaksiyonlarda proton transferine tünelleme katkısının bir başka örneği, alkol dehidrojenaz tarafından gerçekleştirilen reaksiyondur . 25 °C'de hidrojen transfer aşaması için rekabetçi KIE'ler, birincil ve ikincil KIE'ler için sırasıyla 3.6 ve 10.2 ile sonuçlandı.
Geçici kinetik izotop etkisi
Yukarıda verilen denklemlerle ifade edilen izotopik etki, yalnızca birinci dereceden kinetik ile tanımlanabilen tepkimeleri ifade eder . Bunun mümkün olmadığı tüm durumlarda , GEBIK ve GEBIF denklemleri kullanılarak geçici kinetik izotop etkileri dikkate alınmalıdır.
deneyler
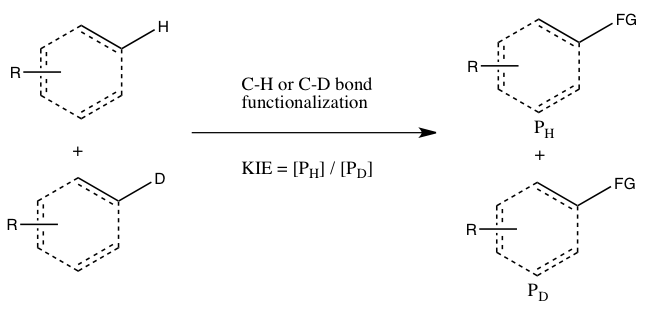
Simmons ve Hartwig , CH bağ işlevselleştirmesini içeren kinetik izotop etkisi deneylerinin ana türleri olarak aşağıdaki üç duruma atıfta bulunur:
- A) İki paralel reaksiyonun mutlak oranlarından belirlenen KIE
Bu deneyde, normal substrat ve izotopik olarak etiketlenmiş analogu için hız sabitleri bağımsız olarak belirlenir ve KIE, ikisinin oranı olarak elde edilir. Ölçülen KIE'nin doğruluğu, bu hız sabitlerinin her birinin ölçülebildiği doğrulukla ciddi şekilde sınırlıdır. Ayrıca, iki paralel reaksiyondaki kesin koşulları yeniden oluşturmak çok zor olabilir. Bununla birlikte, hız sabitlerinin doğrudan karşılaştırılması yoluyla büyük bir kinetik izotop etkisinin ölçümü, hız belirleme aşamasında CH bağ bölünmesinin meydana geldiğinin göstergesidir. (Daha küçük bir değer, bir ön denge nedeniyle bir izotop etkisini gösterebilir, böylece CH bağ bölünmesi hız belirleyici adımdan önce bir yerde gerçekleşir.)
- B) Moleküller arası bir rekabetten belirlenen KIE
Bu tip deneyde, Deney A'da kullanılan aynı substratlar kullanılır, ancak iki ayrı kap yerine aynı kap içinde reaksiyona girmelerine izin verilir. Bu deneyden elde edilen kinetik izotop etkisi, CH'ye karşı CD işlevselleştirmesinden oluşan ürünlerin nispi miktarı ile belirlenir (veya reaksiyona girmemiş başlangıç malzemelerinin nispi miktarlarından çıkarılabilir). Kinetik izotop etkisini gözlemlemek için tamamlanmadan önce reaksiyonu söndürmek gerekir (aşağıdaki Değerlendirme bölümüne bakın). Genellikle reaksiyon, düşük dönüşümde (~5 ila %10 dönüşüm) durdurulur veya izotopik karışımın büyük bir fazlası (> 5 eşdeğer) kullanılır. Bu deney türü, hem CH hem de CD bağ işlevselleştirmelerinin tam olarak aynı koşullar altında gerçekleşmesini sağlar ve CH ve CD bağ işlevselleştirmelerinden elde edilen ürünlerin oranı, Deney A'daki hız sabitlerinden çok daha büyük bir hassasiyetle ölçülebilir. Ayrıca, yalnızca tek bir ölçüm ürün konsantrasyonlarının tek bir numuneden alınması gerekir. Bununla birlikte, bu deneyden gözlemlenen bir kinetik izotop etkisinin yorumlanması daha zordur, çünkü bu, ya CH bağ klevajının hız-belirleme aşaması sırasında ya da hız-belirleme aşamasını takip eden bir ürün-belirleme aşamasında meydana geldiği anlamına gelebilir. En azından Simmons ve Hartwig'e göre bir kinetik izotop etkisinin olmaması, yine de, hız belirleme aşaması sırasında meydana gelmeyen CH bağ bölünmesinin göstergesidir.
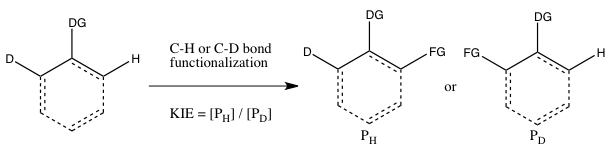
- C) Moleküller arası bir rekabetten belirlenen KIE
Bu tür deney, Deney B'ye benzerdir, ancak bu sefer CH veya CD bağı işlevselleştirmesi için moleküller arası bir rekabet vardır. Çoğu durumda, substrat, CH ve CD bağları arasında bir yönlendirici gruba (DG) sahiptir. Bu deneyden elde edilen kinetik izotop etkisinin hesaplanması ve yorumlanması, Deney B'deki ile aynı hususları takip eder. Bununla birlikte, izotop içeren substratın geri döndürülemez bağlanması Deney B'de bundan önce gerçekleşirse, Deney B ve C'nin sonuçları farklı olacaktır . CH veya CD bağının bölünmesi. Böyle bir senaryoda, Deney C'de bir izotop etkisi gözlemlenebilir (burada izotop seçimi substrat bağlanmasından sonra bile gerçekleşebilir), ancak Deney B'de gözlemlenmez (çünkü CH veya CD bağ parçalamalarının seçimi en kısa sürede yapılır. substrat geri döndürülemez şekilde bağlanır). Deney B'nin aksine, doğru bir k H / k D elde etmek için düşük izotopik başlangıç materyali tüketiminde reaksiyonun durdurulması gerekmez , çünkü başlangıç materyalindeki H ve D oranı, ne olursa olsun 1:1'dir. dönüşüm derecesi.
Moleküller arası (Deney B) ve moleküller arası (Deney C) rekabet durumunda gözlemlenen farklı izotop etkilerinin CH olmayan bir aktivasyon örneği, t- bütilamin varlığında difenildiazometanın fotolizidir . Bu sonucu açıklamak için, difenilkarben oluşumu, ardından t- butilamin tarafından geri dönüşümsüz nükleofilik saldırı önerildi. Nükleofilik saldırı oranında çok az izotopik fark olduğu için, moleküller arası deney 1'e yakın bir KIE ile sonuçlandı. 2.6'nın önemli bir KIE'si var.
Bu nedenle, Deney A, B ve C, farklı kesinlik seviyelerinde sonuçlar verecek ve farklı deneysel kurulum ve verileri analiz etme yolları gerektirecektir. Sonuç olarak, her bir deney türünün uygulanabilirliği, reaksiyonun kinetik ve stokiyometrik profilinin yanı sıra reaksiyon karışımının fiziksel özelliklerine (örneğin homojen ve heterojen) bağlı olacaktır. Ayrıca, yukarıdaki paragrafta belirtildiği gibi, deneyler, hız sınırlayıcı adımın, ürün belirleme adımlarının ve/veya CH/D bölünmesinin nispi konumlarına bağlı olarak, çok adımlı bir reaksiyonun farklı adımları için kinetik izotop etkisi verileri sağlar. adım.
Aşağıdaki varsayımsal örnekler, yaygın senaryoları göstermektedir. Aşağıdaki reaksiyon koordinat diyagramını göz önünde bulundurun. Bu profille bir reaksiyon için, üç deneyin tümü (A, B ve C) önemli bir birincil kinetik izotop etkisi verecektir:
Öte yandan, eğer bir reaksiyon, CH veya CD bağ bölünmesinin geri döndürülemez olduğu ancak hız belirleyici adımdan (RDS) sonra meydana geldiği aşağıdaki enerji profilini takip ederse, Deney A ile önemli bir kinetik izotop etkisi gözlemlenmeyecektir, çünkü genel oran, izotopik ikameden etkilenmez. Bununla birlikte, tersinmez CH bağ klevaj aşaması, ikinci aşama hala ürün dağılımını etkileyeceğinden, diğer iki deneyde birincil kinetik izotop etkisi verecektir. Bu nedenle, Deney B ve C ile, CH veya CD bağ bölünmesi hız belirleme aşamasında değil, ürün belirleme aşamasında meydana gelse bile kinetik izotop etkisini gözlemlemek mümkündür.
Kinetik izotop etkisinin büyük bir kısmı, reaktant temel durumu ile reaktan ve izotopik olarak ikame edilmiş analogu arasında değişen geçiş durumu arasındaki titreşimsel sıfır noktası enerji farklarından kaynaklanır. Hesaplamalı kimya kullanılarak kinetik izotop etkilerinin ilgili hesaplamalarını yürütmek mümkün olsa da, yapılan çalışmaların çoğu, belirli izotopik ikamelerin saptanabilir bir kinetik izotop etkisi üretip üretmediğinin araştırılmasını içeren daha basit düzendedir. Reaksiyonun meydana geldiği yerden uzaktaki atomlarda izotopik yer değiştirmeden kaynaklanan titreşim değişiklikleri, reaktan ve geçiş durumu arasında iptal olma eğilimindedir. Bu nedenle, bir kinetik izotop etkisinin varlığı, izotopik olarak etiketlenmiş atomun reaksiyon bölgesinde veya çok yakınında olduğunu gösterir.
Bir izotop etkisinin yokluğunu yorumlamak daha zordur: Bu, izotopik olarak etiketlenmiş atomun reaksiyon bölgesinden uzakta olduğu anlamına gelebilir, ancak aynı zamanda gözlemlenebilir bir kinetik izotop etkisinin olmamasına yol açan belirli telafi edici etkilerin olduğu anlamına da gelebilir. Örneğin, reaktan ve geçiş durumu sıfır noktası enerjileri arasındaki farklar, normal reaktan ve izotopik olarak etiketlenmiş versiyonu arasında aynı olabilir. Alternatif olarak, bu, izotopik yer değiştirmenin reaksiyon bölgesinde olduğu anlamına gelebilir, ancak bu atoma olan bağlarla ilişkili titreşimsel değişiklikler, hız belirleme adımından sonra meydana gelir. ABCD'nin bir molekülün atomik iskeletini temsil ettiği aşağıdaki örnekte böyle bir durum gösterilmektedir.
ABC ara maddesi için kararlı durum koşulları varsayıldığında, toplam reaksiyon hızı aşağıdaki gibidir:
İlk adım hız belirleyici ise, bu denklem şuna indirgenir:
Veya ikinci adım hız belirleyici ise, denklem şuna indirgenir:
Çoğu durumda, A izotopik ikame, ağır bir atomu, özellikle de değiştirmez k 1 ya da k 2 , fakat öteki en muhtemelen olacaktır k 3 . Bu nedenle, eğer birinci adım hız belirleyici ise, A'nın izotopik etiketlemesi ile genel reaksiyonda gözlemlenebilir bir kinetik izotop etkisi olmayacaktır, ancak ikinci adım hız belirleyici ise bir tane olacaktır. Her iki adım benzer bilgisi ara durumlar için, kinetik izotop etkisi büyüklüğü oranına bağlı olacaktır k 3 ve k 2 .
D izotopik ikame değiştirecektir k 1 ve k 2 etkilemeden k 3 . Kinetik izotop etkisi daima beri bu ikamesi ile gözlemlenebilir olacak k 1 İkinci adım hız belirleyici ise sebebiyle izotop arasında bazı iptaline bakılmaksızın hız belirleyici olan adımı basitleştirilmiş oranı ifadesinde göründüğünü, ama daha az belirgin olacak k 1 ve k 2 üzerindeki etkiler . Bu sonuç, denge izotop etkilerinin genellikle kinetik izotop etkilerinden daha küçük olması gerçeğiyle ilgilidir.
B izotopik ikame alter açık olacaktır k 3 , ama aynı zamanda değiştirebilir k 1 BC bağ titreşimler ilk aşamanın geçiş aşamasmda daha az bir ölçüde etkilenmesi durumunda. Bu nedenle, ilk adım hız belirleyici olsa bile küçük bir izotop etkisi olabilir.
Bu varsayımsal değerlendirme, kinetik izotop etkilerinin gözlemlenmesinin reaksiyon mekanizmalarını araştırmak için nasıl kullanılabileceğini ortaya koymaktadır. Kinetik bir izotop etkisinin varlığı, hız kontrol adımında veya öncesinde izotopik olarak etiketlenmiş atomla bağlantılı bir bağın titreşim kuvveti sabitinde bir değişikliğin göstergesidir. Gözlemlenen kinetik izotop etkilerinden geçiş durumu hakkında büyük miktarda ayrıntı öğrenmek için karmaşık hesaplamalar kullanılabilir. Bununla birlikte, daha yaygın olarak, izotopik olarak etiketlenmiş atomla ilişkili bir bağın belirli bir şekilde değiştirildiğine dair yalnızca niteliksel bilgi çok faydalı olabilir.Moleküller arası rekabet reaksiyonlarından hız sabit oranlarının değerlendirilmesi
Rekabet reaksiyonlarında, kinetik izotop etkisi, reaksiyondan sonra izotopik ürün veya kalan reaktan oranlarından hesaplanır, ancak bu oranlar, reaksiyonun tamamlanma derecesine büyük ölçüde bağlıdır. En yaygın olarak, izotopik substrat, belirli bir pozisyonda etiketlenmiş moleküllerden ve bunların etiketlenmemiş, sıradan karşılıklarından oluşacaktır. Bu durumda da mümkündür 13 , C kinetik izotop etkileri yanı sıra benzer durumlarda sadece izotopik etiketleme ihtiyacını ortadan kaldırarak, kinetik izotop etkisi deneyleri için izotop karbonun doğal bolluğu güvenmek. İki izotopik substrat aynı mekanizmayla, ancak farklı hızlarda reaksiyona girer. Reaktanlardaki ve ürünlerdeki iki türün miktarları arasındaki oran, bu nedenle, reaksiyon boyunca kademeli olarak değişecektir ve bu kademeli değişim aşağıdaki şekilde ele alınabilir: İki izotopik molekülün, A 1 ve A 2 olduğunu varsayalım , aşağıdaki şekilde tersinmez rekabet reaksiyonlarına girerler:
Bu senaryo için kinetik izotop etkisi şu şekilde bulunur:
F nerede 1 ve F 2 izotopik türlerin bir dönüşümlerin fraksiyonu bakınız 1 ve A 2 , sırasıyla.
Bu tedavide, diğer tüm reaktanların izotop olmadığı varsayılır. Ayrıca reaksiyonun izotopik substrat A'ya göre birinci dereceden olduğu varsayılarak, bu reaksiyonların her ikisi için aşağıdaki genel hız ifadesi yazılabilir:
f([B],[C],…) A'nın izotopik bileşimine bağlı olmadığından, her iki hız ifadesinde de A 1 ve A 2 ile çözülebilir ve ikisi , aşağıdaki bağıntıları türetmek için eşitlenebilir. :
Burada [A 1 ] 0 ve [A 2 ] 0 , sırasıyla A 1 ve A 2'nin başlangıç konsantrasyonlarıdır . Bu, aşağıdaki kinetik izotop etkisi ifadesine yol açar:
Bu aynı zamanda, n = 1 veya 2 için 1-F n =[A n ]/[A n ] 0 olmak üzere iki reaksiyonun, F 1 ve F 2 dönüşümünün fraksiyon miktarları cinsinden ifade edilebilir:
Kinetik izotop etkilerinin elde edilmesine gelince, stabil izotoplar içeren substrat karışımları, başlangıç substratındaki izotopik moleküllerin oranlarını veren bir kütle spektrometresi kullanılarak analiz edilebilir (burada [A 2 ] 0 /[A 1 ] 0 = olarak tanımlanır). R 0 ), bir miktar dönüşümden sonra substratta ([A 2 ]/[A 1 ]=R) veya üründe ([P 2 ]/[P 1 ]=R P ). Türlerden biri, örneğin 2, bir radyoaktif izotop olduğunda, diğer türlerle olan karışımı, [A 2 ] 0 / ([A 1 ] 0 ile orantılı molar aktivitelerde ölçülen radyoaktivitesi ile de analiz edilebilir. +[A 2 ] 0 ) ≈ [A 2 ] 0 /[A 1 ] 0 = R 0 ilk alt tabakada, [A 2 ] / ([A 1 ]+[A 2 ]) ≈ [A 2 ]/[ A 1 ] = R, bir miktar dönüştürmeden sonra substratta ve [R 2 ] / ([R 1 ]+[R 2 ]) ≈ [R 2 ]/[R 1 ] = RP , böylece aşağıdaki oranlar aynı olur diğer durum, radyoaktif izotop izleyici miktarlarda bulunduğu sürece ölçülebilir. Bu oranlar, NMR spektroskopisi kullanılarak da belirlenebilir.
Alt-tabaka bileşimin devam edildiğinde, R 'olarak aşağıdaki kinetik izotop etkisi ifadesi 0 ve R' elde edilebilir:
F 2 için önceden türetilmiş ifade kullanılarak R ve R 0 oranı alındığında , biri şunu elde eder:
Başlangıç malzemesinin izotopik zenginleştirme bağımlılığı hesaplanabilir R / R 0 ile F 1 Aşağıdaki şekil, sonuçta çeşitli kinetik izotop etkisi açısından değerlendirildiler. Üstel bağımlılık nedeniyle, çok düşük kinetik izotop etkileri bile, yüksek dönüşümlerde başlangıç malzemesinin izotopik bileşiminde büyük değişikliklere yol açar.
Ürünler takip edildiğinde, kinetik izotop etkisi, ürün oranı R P ve R 0 kullanılarak aşağıdaki gibi hesaplanabilir:
Doğal bollukta kinetik izotop etkisi ölçümü
Doğal bollukta kinetik izotop etkisi, ölçüm için kinetik izotop etkileri (KİE) ölçmek için basit bir genel yöntemdir kimyasal reaksiyonların malzeme ile gerçekleştirilen doğal miktarı . KIE'leri ölçmek için bu teknik, önceki KIE ölçüm yöntemlerinin birçok sınırlamasının üstesinden gelir. İzotopik olarak etiketlenmiş malzemelerden yapılan KIE ölçümleri, izotopik olarak etiketlenmiş her malzeme için yeni bir sentez (genellikle engelleyici derecede zor bir süreç), bir rekabet reaksiyonu ve bir analiz gerektirir. En KİE ölçüm doğal miktarı yüksek hassasiyetli niceliksel teknikler (yararlanarak bu sorunları ortadan kaldırır , nükleer manyetik rezonans spektroskopisi , izotop oranı kütle spektrometrisi seçici ölçmek sitesine) kinetik fraksiyonasyon bölgesinin izotopları , belirli bir malzeme için her iki ürün de, veya başlangıç kimyasal reaksiyon .
Tek darbeli NMR
Kantitatif tek darbe nükleer manyetik rezonans spektroskopisi (NMR) ile için bir metot müsait kinetik fraksiyonasyon bölgesinin izotopları doğal miktarında KİE ölçümleri için. Pascal et al. Farklı kaynaklardan gelen özdeş bileşikler içinde döteryumun dramatik varyasyonlarını gösteren çalışmalardan ilham aldılar ve NMR'nin doğal bollukta döteryum kinetik izotop etkilerini ölçmek için kullanılabileceğini varsaydılar. Pascal ve çalışma arkadaşları , dimetil diazomalonatın sikloheksan içine sokma reaksiyonunu inceleyerek hipotezlerini test ettiler . Pascal et al. kullanarak 2.2'lik bir KIE ölçtü2
H
Doğal bolluk malzemeleri için NMR.
Singleton ve iş arkadaşları, 13
C
NMR [4 + 2] mekanizmasını araştırmak için, doğal miktarında KİE ölçümleri göre siklo arasında izopren ile maleik anhidrit . Gajewski'nin izotopik olarak zenginleştirilmiş malzemeler üzerindeki önceki çalışmaları, asenkron bir geçiş durumu öneren, ancak mükemmel bir senkronize reaksiyon mekanizması için her zaman tutarlı, hata içinde olan KIE sonuçlarını gözlemledi .
Bu çalışma Singleton ve ark. çoklu ölçüm kurdu13
C
KIE'ler tek bir deney tasarımı içindedir. Bunlar2
H
ve 13
C
Doğal bollukta belirlenen KIE ölçümleri, dien deneyiminin "iç" hidrojenlerinin daha belirgin olduğunu buldu. 2
H
KIE, “dış” hidrojenlerden” ve C1 ve C4 önemli bir KIE yaşar. Bu önemli gözlemler , izoprenin maleik anhidrit ile siklo ilavesi için asenkron bir reaksiyon mekanizması önermektedir .
NMR kullanarak doğal bollukta KIE'leri belirleme sınırlamaları, geri kazanılan malzemenin NMR analizi için uygun bir miktar ve saflığa sahip olması (ilgilenen sinyal diğer sinyallerden farklı olmalıdır), ilgilenilen reaksiyonun geri döndürülemez olması ve reaksiyon mekanizmasıdır. kimyasal reaksiyon süresince değişmemelidir .
Doğal bollukta kinetik izotop etkisini ölçmek için kantitatif tek darbeli NMR kullanmak için deneysel ayrıntılar aşağıdaki gibidir: deneyin, 5 T 1 gevşeme süresi , ölçülen 90° çevirme açısı, en az 5 dijital çözünürlük dahil olmak üzere kantitatif koşullar altında gerçekleştirilmesi gerekir. bir tepe noktasındaki noktalar ve 250'den büyük bir sinyal:gürültü. Ham FID, Fourier dönüşümünden önce en az 256K noktaya kadar sıfır doldurulur. NMR spektrumları aşamalandırılır ve daha sonra herhangi bir eğim düzeltmesi olmaksızın sıfırıncı dereceden bir taban çizgisi düzeltmesi ile işlenir. Sinyal entegrasyonları, her bir entegre sinyal için minimum toleransla sayısal olarak belirlenir.
Organometalik reaksiyon mekanizması açıklama örnekleri
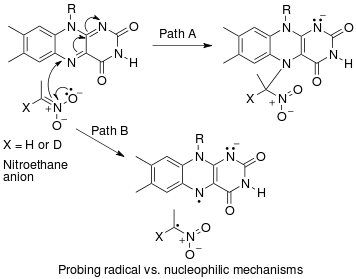
Colletto et al. benzo[b]tiyofenlerin oda sıcaklığında aril iyodürleri eşleme partnerleri olarak regioselektif bir arilasyonu geliştirdi ve tek darbeli NMR ile doğal bolluk kinetik izotop etkisi ölçümleri yaparak bu reaksiyonun mekanizmasını anlamaya çalıştı.
Birincil gözlemlenmesi 13 C3'teki Cı izotop etkisi, bir ters 2 H izotop etkisi, ikinci bir 13 C2 Cı izotop etkisi ve bir eksikliği 2 C2 H izotop etkisi Colletto yol ve diğ. benzo[b]tiofenlerin oda sıcaklığında aril iyodürlerle eşleme partnerleri olarak bölgesel seçici arilasyonu için Heck tipi bir reaksiyon mekanizması önermek .
Frost ve ark. tek darbeli NMR yoluyla doğal bolluk kinetik izotop etkisi ölçümlerini kullanarak enantioselektif paladyum katalizli CN bağ aktivasyonunun mekanizması üzerindeki Lewis asidi katkı maddelerinin etkilerini anlamaya çalıştı .
Primer 13 BPH yokluğunda gözlenen Cı kinetik izotop etkisi 3 oranı C-CN bağlantı içine sis oksidasyon sınırlayıcı bir reaksiyon mekanizmasını göstermektedir cyanoformamide . BPH eklenmesi 3 nispi azalma gözlenmiştir neden 13 Frost yol Cı kinetik izotop etkisi ve diğ. cis oksidasyonundan paladyumun siyanoformamide koordinasyonuna hız sınırlayıcı adımda bir değişiklik önermek.
DEPT-55 NMR
Doğal bollukta kinetik izotop etkisi ölçümleri, reaksiyon mekanizmalarını anlamak için güçlü bir araç olmasına rağmen, analiz için gerekli malzeme miktarları, pahalı reaktifler veya kararsız başlangıç malzemeleri kullanan reaksiyonlar için bu tekniği erişilemez hale getirebilir. Bu sınırlamaları en aza indirmek için, Jacobsen ve arkadaşları, gelişmiş 1 H olarak 13 doğal miktarı kinetik izotop etkisi ölçümleri için gerekli olan zaman ve malzeme azaltmak için bir vasıta olarak Cı polarizasyon transferi. Polarizasyon transferi ile Bozulmasız Geliştirme (DEPT) büyük yararlanır dönermıknatıslık oranı arasında 1 saat boyunca 13 teorik olarak 16 bir faktör ile 4 ya da azalma deney süresi bir faktör tarafından, ölçme hassasiyetini arttırmak için C, doğal bolluk kinetik izotop ölçümü için bu yöntem, Kararsız başlangıç malzemeleri ve nispeten maliyetli katalizörler veya ürünler içeren reaksiyonların analizi için uygundur.
Jacobsen ve çalışma arkadaşları, galaktozun tiyoüre katalizli glikosilasyonunu, yukarıda belirtilen kriterlerin her ikisini de (pahalı malzemeler ve kararsız substratlar) karşılayan bir reaksiyon olarak tanımladılar ve tam olarak anlaşılmayan bir mekanizmaya sahip bir reaksiyondu. Glikosilasyon, S N 1 ve S N 2 mekanik karakter arasında net bir tanımdan yoksun olan özel bir nükleofilik ikame durumudur . Yer değiştirme bölgesine bitişik oksijenin varlığı (yani, C1), pozitif yükü stabilize edebilir. Bu ücret, stabilizasyon olası uyumlu yol uyumsuz olmasına neden ve S oxocarbenium karakteri ile ara-yaklaşımları için , N , glikozilasyon için 1 mekanizması.
Jacobsen ve çalışma arkadaşları, C1, C2 ve C5'te küçük normal KIE'ler gözlemlediler, bu da geçiş durumunda önemli oksokarbenyum karakterini ve yüksek derecede yük ayrımı olan bir asenkron reaksiyon mekanizmasını ortaya koydu.
İzotop oranlı kütle spektrometrisi
Yüksek hassasiyetli izotop oranı kütle spektrometrisi (IRMS) ölçülmesi için başka bir yöntemdir kinetik fraksiyonasyon bölgesinin izotopları doğal miktarında KİE ölçümleri için. Widlanski ve iş arkadaşları gösterdi34
S
Doğal bolluk ölçülerde KİE hidroliz arasında sülfat monoesterleri. Büyük bir KIE gözlemleri, SO bağ bölünmesinin hız kontrolü olduğunu ve muhtemelen bir ortak reaksiyon mekanizmasını dışladığını öne sürüyor .
IRMS kullanarak doğal bollukta KIE'leri belirlemenin ana sınırlaması, önemsiz olmayan bir görev olan analiz edilebilir küçük bir moleküle izotopik fraksiyonlama olmaksızın gerekli alan seçici bozunmadır.
Durum çalışmaları
Birincil hidrojen izotop etkileri
Birincil hidrojen kinetik izotop etkileri, bir reaksiyonun hız ve/veya ürün belirleyici adımında izotopik olarak etiketlenmiş hidrojene bir bağın oluştuğu veya kırıldığı durumları ifade eder. Bunlar en yaygın olarak ölçülen kinetik izotop etkileridir ve daha önce kapsanan teorinin çoğu birincil kinetik izotop etkilerine atıfta bulunur. Etiketli hidrojen transferinin reaksiyonun hız belirleme adımında gerçekleştiğine dair yeterli kanıt olduğunda, oldukça büyük bir kinetik izotop etkisi gözlemlenirse, örneğin en az 5-6 kH/kD veya yaklaşık 10-13 kH/kT oda sıcaklığında, hidrojen transferinin lineer olması ve hidrojenin geçiş durumunda oldukça simetrik olarak yer alması oldukça muhtemeldir. Etki çok büyük olmadıkça, gözlemlenen izotop etkisine tünelleme katkıları hakkında yorum yapmak genellikle mümkün değildir. Birincil kinetik izotop etkisi o kadar büyük değilse, hidrojen transferinin doğrusal olmayan bir yol izlediği anlamına gelse de, genellikle ağır atom hareketinden reaksiyon koordinatına önemli bir katkının göstergesi olarak kabul edilir.
İkincil hidrojen izotop etkileri
İkincil hidrojen izotop etkileri veya ikincil kinetik izotop etkisi (SKIE), izotopik ikamenin kırılan bağdan uzak olduğu durumlarda ortaya çıkar. Yine de uzak atom, sıfır noktası enerjisindeki (ZPE) değişiklikler yoluyla kimyasal reaksiyon oranlarını etkileyen sistemin iç titreşimlerini etkiler. Bu tür etkiler, hafif izotopun ağır izotopun hızına oranları olarak ifade edilir ve "normal" (oran 1'e eşit veya daha büyük) veya "ters" (oran 1'den küçüktür) etkiler olabilir. SKIE, α,β (vs.) ikincil izotop etkileri olarak tanımlanır; burada bu tür önekler, reaksiyon merkezine göre izotopik yer değiştirmenin konumuna atıfta bulunur (bkz. alfa ve beta karbon ). α öneki, reaksiyon merkeziyle ilişkili izotopu belirtirken, β öneki , reaksiyon merkezine komşu bir atomla ilişkili izotopu belirtir vb.
Fiziksel organik kimyada SKIE, indüksiyon, bağ hibridizasyonu veya hiperkonjugasyon gibi elektronik etkiler açısından tartışılmaktadır . Bu özellikler elektron dağılımı ile belirlenir ve titreşimsel ortalamalı bağ uzunluğuna ve izotopik yer değiştirmeden büyük ölçüde etkilenmeyen açılara bağlıdır. Bu nedenle, meşru iken "elektronik izotop etkisi" teriminin kullanılması, izotop etkisinin titreşimden ziyade elektronik nitelikte olduğunu önermek için yanlış yorumlanabileceğinden, kullanılması önerilmez.
SKIE'ler yörünge hibridizasyonundaki değişikliklerle açıklanabilir. Sp bir karbon atomu değişiklikleri hibridizasyon zaman 3 sp 2 , titreşim modları (düzlemsel uzanan ve üzerinden düzlem-dışı eğilme) bir dizi etkilenir. Bir sp bükme düzlem ve dışı düzlemi 3 hibritlenmiş karbon bağlı bir sp simetri frekans benzerdir 3 hibritlenmiş karbon. Bir SP 2 hibritlenmiş karbon düzlem bükülme çok daha serttir üzerinden düzlem-dışı sıklığı, büyük bir fark ortaya bükme ZPE arasında ZPE bir fark olduğunda mevcuttur ve böylece skie ( reaktan ve geçiş durumu). Eğilme frekansı farkının neden olduğu teorik maksimum değişim 1.4 olarak hesaplanmıştır.
C-sp olan hibridizasyon değiştiren bir reaksiyona tabi olduğunda 3 sp 2 sp geliştirmek üzere, geçiş durumunun kuvvet sabit düzlem dışı zayıf 2 1.1 tipik değerlere sahip görülmektedir karakter ve "normal" bir skie 1.2. Sp karbonun hibridizasyon değişiklikler Tersine, 2 sp 3 , geçiş durumu artışla kuvvet sabitleri düzlem dışı ve ters skie 0.9 0.8 tipik değerleri görülmektedir.
Daha genel olarak, tersinir reaksiyonlar için SKIE, eğer geçiş durumundaki bağlanma, substrat ve ürün arasındaki sertlikte ortada ise, bir yönde "normal" ve diğerinde "ters" olabilir veya bağlanma daha zayıfsa, her iki yönde de "normal" olabilir. geçiş durumu veya geçiş durumunda bağ her iki reaktandan daha güçlüyse her iki şekilde "ters".
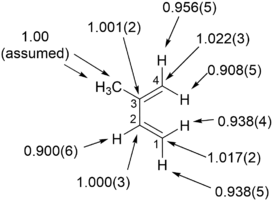
Bir "ters" a ikincil kinetik izotop etkisinin bir örneği, d-amino asit oksidazın nitroalkan anyonları ile reaksiyonu için önerilen iki yolu ayırt etmek için böyle bir etki kullanan Fitzpatrick ve Kurtz'un çalışmasında görülebilir . Yol A, koenzim FAD üzerinde bir nükleofilik saldırıyı içerirken, yol B bir serbest radikal ara ürününü içerir. A yolu, sp 2'den sp 3'e ara karbon değiştiren hibridizasyonla sonuçlandığından, bir "ters" a SKIE beklenir. B yolu oluşursa, serbest radikal ara ürünü hibridizasyonu değiştirmediğinden hiçbir SKIE gözlemlenmemelidir. 0.84'lük bir SKIE gözlendi ve aşağıdaki şemada gösterildiği gibi Yol A doğrulandı.
Bir SKIE'nin başka bir örneği, farklı mekanizmalar için üç geçiş durumunun önerildiği benzil alkollerin dimetildioksiran tarafından oksidasyonudur. Yine, hidrojen atomlarının her birine nasıl ve ne şekilde dahil olduğunu göz önünde bulundurarak, araştırmacılar, bunların izotopik ikamesinin bir etkisi olup olmayacağını tahmin ettiler. Ardından, reaksiyon için deneysel verilerin analizi, gözlemlenen izotop etkisine dayalı olarak hangi yolun daha muhtemel olduğunu seçmelerine izin verdi.
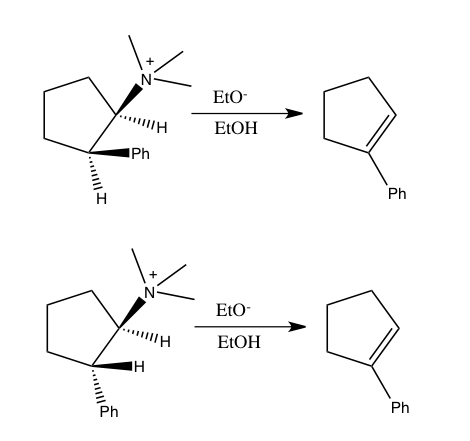
Metilen hidrojenlerinden ikincil hidrojen izotop etkileri de 1,5-heksadien içindeki Cope yeniden düzenlemesinin uyumlu bir bağ yeniden düzenleme yolunu izlediğini ve alternatif olarak önerilen allil radikali veya 1,4-diil yollarından biri olmadığını göstermek için kullanıldı. aşağıdaki şemada sunulmuştur.
1,5-heksadienin Cope yeniden düzenlenmesi için alternatif mekanizmalar: (yukarıdan aşağıya), alil radikali, senkronize uyumlu ve 1,4-diil yolları. Baskın yolun, aromatik bir ara maddeye karşılık gelen altı delokalize π elektronuna sahip olan orta yol olduğu bulunmuştur.
Sterik izotop etkileri
|
|
|
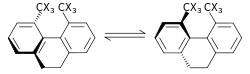
Sterik izotop etkisi, bağ kırılması veya oluşumu içermeyen bir SKIE'dir. Bu etki, izotopologların farklı titreşim genliklerine atfedilir . Böyle bir etkinin bir örneği, 9,10-dihidro-4,5-dimetilfenantrenin rasemizasyonudur . C-H (karbon-hidrojen), C-D (karbon-döteryum) bağlarındaki hidrojen ile karşılaştırıldığında döteryum için daha küçük titreşim genliği, ZPE'deki farka ek olarak daha küçük bir van der Waals yarıçapı veya etkili boyut ile sonuçlanır. iki. Birini diğerinin üzerinde içeren daha etkili bir molekül yığını olduğunda, bu, hız sabiti üzerindeki sterik bir etki ile kendini gösterebilir. Yukarıdaki örnekte, döteryum, hidrojen izotopologundan daha hızlı rasemleşir ve sterik bir izotop etkisine neden olur. Bartell tarafından sterik izotop etkisi için bir model geliştirilmiştir. Bir sterik izotop etkisi, dönüşümler, yukarıda gösterilen rasemizasyon işleminde olduğu gibi, şiddetli sterik tıkanıklıkla bir geçiş durumundan geçmedikçe genellikle küçüktür.
Sterik izotop etkisinin bir başka örneği, rotaksanların kayma reaksiyonudur. Döteryum izotopu, daha küçük etkili boyutu nedeniyle, durdurucuların makro döngüden daha kolay geçişine izin vererek, döteryumlu rotaksanlar için daha hızlı kayma oranları sağlar .
Ters kinetik izotop etkileri
Dötere edilmiş türlerin, döteryumsuz analogdan daha hızlı tepki verdiği yerlerde reaksiyonlar bilinir ve bu durumların ters kinetik izotop etkileri (IKIE) sergilediği söylenir. IKIE'ler genellikle alkil metal hidritlerin indirgeyici eliminasyonunda gözlemlenir , örneğin ( Me 2 NCH 2 CH 2 NMe 2 )PtMe(H). Bu gibi durumlarda, bir agostik tür olan geçiş durumundaki CD bağı , C-H bağına göre oldukça kararlıdır .
Eğer toplam hız sabiti , bir ters denge izotop etkisine sahip olan hız belirleyici adımdan önceki bir ön dengeye bağlıysa, çok adımlı bir reaksiyonda ters bir etki de meydana gelebilir . Örneğin, oranları asit katalizli reaksiyonlara D reaksiyonlar için genellikle 2-3 kat daha fazla olan 2 D ile katalize O 3 O + H analog reaksiyonlar için daha 2 H ile katalize O 3 O + Bu a için açıklanabilir mekanizması spesifik hidrojen iyonu katalizi H ile bir reaktant R 3 O + (ya da D 3 O + ).
- H 3 O + + R ⇌ RH + + H 2 O
- RH + + H 2 O → H 3 O + + P
Ürünlerin oluşum hızı daha sonra d[P]/dt = k 2 [RH + ] = k 2 K 1 [H 3 O + ][R] = k obs [H 3 O + ][R] olur. İlk adımda, H 3 O + genellikle RH + ' dan daha güçlü bir asittir . Deuteration kaymalar daha güçlü bir şekilde bağlanmış asit türleri RD doğru denge + sıfır noktası titreşim enerjisine deuteration etkisi daha büyük olduğu, bu yüzden döteryumlanmış Denge sabiti K olduğu 1D K daha büyüktür 1H . İlk aşamadaki bu denge izotop etkisi genellikle ikinci aşamadaki kinetik izotop etkisinden daha ağır basar, böylece belirgin bir ters izotop etkisi vardır ve gözlemlenen toplam hız sabiti k obs = k 2 K 1 azalır.
Solvent hidrojen kinetik izotop etkileri
Çözücü izotop etkilerinin ölçülebilir olması için, çözücünün sonlu bir bölümünün diğerlerinden farklı bir izotopik bileşime sahip olması gerekir. Bu nedenle, daha az yaygın olan izotopik türlerin büyük miktarları mevcut olmalıdır, bu da gözlemlenebilir çözücü izotop etkilerini hidrojen içeren izotopik ikamelerle sınırlandırır. Tespit edilebilir kinetik izotop etkileri, yalnızca çözünen maddeler çözücü ile hidrojen değiştirdiğinde veya reaksiyon bölgesinin yakınında belirli bir çözünen-çözücü etkileşimi olduğunda meydana gelir. Bu tür olayların her ikisi de hidrojenin değişebildiği protik çözücüler için ortaktır ve polar moleküllerle dipol-dipol etkileşimleri veya hidrojen bağları oluşturabilirler.
Karbon-13 izotop etkileri
Çoğu organik reaksiyon, bir karbona bağların kopmasını ve yapılmasını içerir; bu nedenle, saptanabilir karbon izotop etkileri beklemek mantıklıdır. Zaman 13 ° C etiket olarak kullanıldığında, izotopun kütlesindeki değişim hidrojen izotop etkileri ile gözlemlenebilir olanlara göre çok daha küçük değerlere gözlemlenebilir kinetik izotop etkileri sınırlayan da sadece yaklaşık% 8, vardır.
13 C doğal bolluğundaki varyasyonları telafi etmek
Çoğu zaman, karbonun doğal bolluk bağlı olan bir çalışmada hata büyük kaynağı doğal hafif varyasyonu 13 C bolluğu kendisi. Bu tür varyasyonlar, reaksiyonda kullanılan başlangıç malzemelerinin, kinetik izotop etkilerine ve ürünlerde karşılık gelen izotopik zenginleşmelere sahip olan bazı diğer reaksiyonların ürünleri olması nedeniyle ortaya çıkar. Kinetik izotop etkisini belirlemek için NMR spektroskopisi kullanıldığında bu hatayı telafi etmek için aşağıdaki kılavuzlar önerilmiştir:
- Referans olarak hizmet edecek reaksiyon merkezinden uzak bir karbon seçin ve reaksiyonda kinetik izotop etkisi olmadığını varsayalım.
- Herhangi bir reaksiyona girmemiş başlangıç materyalinde, diğer karbon NMR tepe integrallerinin referans karbonunkine oranlarını belirleyin.
- Bir miktar reaksiyona girdikten sonra başlangıç materyalinin bir numunesindeki karbonlar için aynı oranları elde edin.
- Sonraki oranların önceki oranlara oranları R/R 0 verir .
Bunlar ve Jankowski tarafından sıralanan diğer bazı önlemler izlenirse, üç ondalık basamağa sahip kinetik izotop etkileri elde edilebilir.
Karbondan daha ağır elementlerle izotop etkileri
Karbon izotop etkilerinin yorumlanması genellikle aynı anda karbon bağları oluşturup kopararak karmaşık hale gelir. S N1 reaksiyonları gibi yalnızca karbondan bağ ayrılmasını içeren reaksiyonlar bile, karbona kalan bağların güçlendirilmesini içerir. Bu tür reaksiyonların çoğunda, ayrılan grup izotop etkilerinin yorumlanması daha kolay olma eğilimindedir. Örneğin, klorun bir ayrılan grup olarak hareket ettiği ikame ve eliminasyon reaksiyonları, özellikle klor, reaksiyon koordinatını karmaşıklaştıracak hiçbir iç bağa sahip olmayan monatomik bir tür olarak hareket ettiğinden ve iki kararlı izotopa, 35 Cl ve 37 Cl'ye sahip olduğundan, yorumlanması uygundur. , her ikisi de yüksek bolluk ile. Bu tür izotop etkilerinin yorumlanmasındaki en büyük zorluk, ayrılan grubun çözülmesidir.
Deneysel belirsizlikler nedeniyle, izotop etkisinin ölçümü önemli belirsizlikler gerektirebilir. Genellikle izotop etkileri, bir dizi izotopomer üzerinde tamamlayıcı çalışmalar yoluyla belirlenir. Buna göre hidrojen izotop etkileri ile ağır atom izotop etkilerinin birleştirilmesi oldukça faydalıdır. Örneğin, hidrojen izotop etkisi ile birlikte nitrojen izotop etkisinin belirlenmesi, 2-feniletiltrimetilamonyum iyonunun etanol içinde etoksit ile 40 °C'deki reaksiyonunun, alternatif uyumlu olmayan mekanizmaların aksine bir E2 mekanizmasını izlediğini göstermek için kullanıldı. Bu sonuç, bu reaksiyon, bir nitrojen izotop etkisi elde edilir gösteren üzerine ulaşılmıştır, k 14 / K 15 ayrılan hidrojende 3.2 bir hidrojen kinetik izotop etkisi ile birlikte 1,0133 ± 0.0002 arasında,.
Benzer şekilde, nitrojen ve hidrojen izotop etkilerinin birleştirilmesi, basit amonyum tuzlarının sentezlenmesinin daha önce tartışma konusu olan uyumlu bir mekanizmayı takip ettiğini göstermek için kullanıldı. 1-phenylcyclopentene verim her ikisi de etoksit, 2-phenylcyclopentyltrimethylammonium iyonu, aşağıdaki iki reaksiyonları, olarak, her iki izomer bir azot izotop etkisi sergilemiştir k 14 / K 15 60 ° C'de karıştırıldı. Syn eliminasyonunu takip eden trans izomerinin reaksiyonu, anti eliminasyona (1.0108) maruz kalan cis izomerine kıyasla daha küçük bir nitrojen kinetik izotop etkisine (1.0064) sahip olsa da, her iki sonuç da CN bağının zayıflamasının göstergesi olacak kadar büyüktür. uyumlu bir süreçte gerçekleşecek olan geçiş durumunda.
Diğer örnekler
Kinetik izotop etkileri, izotopik kütlelerdeki farklılıklardan kaynaklandığından, gözlemlenebilir en büyük kinetik izotop etkileri, hidrojenin döteryum (kütlede %100 artış) veya trityum (kütlede %200 artış) ile izotopik ikameleri ile ilişkilidir. İzotopik kütle oranlarından kaynaklanan kinetik izotop etkileri, müonlar kullanılarak 36.4 kadar büyük olabilir. Bir elektronun 206 elektron kütlesine sahip pozitif bir müon (μ + ) "çekirdeği" etrafında döndüğü 0.11 H (0.113 amu) en hafif hidrojen atomunu ürettiler . Ayrıca, helyumdaki bir elektronu negatif bir müon (μ − ) ile değiştirerek en ağır hidrojen atomu analogunu hazırladılar ve atom kütlesi 4.116 amu olan Heμ'yu oluşturdular. Negatif Muon bir elektron daha ağır olduğu için, etkili bir şekilde Heμ gibi davranmasına yapım bir protonu koruyucu, çekirdeğe daha yakın yörüngeleri 4.1 bu egzotik türleri ile H., H reaksiyon 1 H 2'de araştırılmıştır. Hafif ile ağır hidrojen analogları reaksiyona hız sabitleri 1 H 2'ye sonra hesaplamak için kullanılmıştır k 0.11 / k 4,1 izotopik kitleler bir 36.4 kat fark olduğu kinetik izotop etkisi,. Bu reaksiyon için, izotopik ikame, ters bir kinetik izotop etkisi yaratır ve yazarlar , şimdiye kadar bildirilen en küçük kinetik izotop etkisi olan 1,74 x 10-4 kadar düşük bir kinetik izotop etkisi bildirirler.
Kinetik izotop etkisi, doğada sentezlendikleri yola bağlı olarak, doğal ürünlerde döteryum izotoplarının belirli bir dağılımına yol açar. NMR spektroskopisi ile, şaraptaki alkolün glikozdan mı yoksa yasadışı olarak eklenen sakarozdan mı fermente edildiğini tespit etmek kolaydır .
Kinetik izotop etkisi kullanılarak aydınlatılan bir başka reaksiyon mekanizması , toluenin halojenasyonudur :
Bu özel "molekül içi KIE" çalışmasında, bir benzilik hidrojen , bromlama maddesi olarak N- bromosüksinimit kullanılarak brom tarafından radikal ikameye tabi tutulur . O PhCH bulunmuştur 3 brominates hızlı PhCD daha 4.86x 3 . 5.56'lık büyük bir KIE, ketonların brom ve sodyum hidroksit ile reaksiyonu ile ilişkilidir .
Bu reaksiyonda hız sınırlayıcı adım, ketonun deprotonasyonu ile enolat oluşumudur . Bu çalışmada KIE, normal 2,4-dimetil-3-pentanon ve onun döteryumlu izomeri için optik yoğunluk ölçümleriyle reaksiyon hızı sabitlerinden hesaplanır .
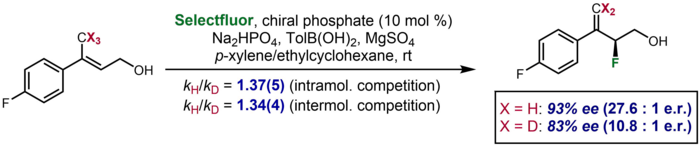
Asimetrik katalizde, kinetik bir izotop etkisinin, döteryumlu bir substrat için gözlenen enantiyoseçicilikte, döteryumsuz bir substratla karşılaştırıldığında önemli bir fark olarak ortaya çıktığı nadir durumlar vardır. Bir örnek, döteryumlu bir substratın, döteryumsuz substrat için %93 ee'ye kıyasla %83 ee'lik bir enantioselektiflik ürettiği Toste ve çalışma arkadaşları tarafından rapor edilmiştir. Etki, enantio-belirleme adımında CH/D bağının bölünmesini öneren ilave moleküller arası ve moleküller arası rekabet KIE verilerini doğrulamak için alındı.
Ayrıca bakınız
- Çapraz deney (kimya)
- Denge sabiti#İzotopik yer değiştirmenin etkisi
- Lipid peroksidasyonu üzerine izotop etkisi
- RuBisCO'nun Kinetik İzotop Etkileri (ribuloz-1,5-bifosfat karboksilaz oksijenaz)
- Manyetik izotop etkisi
- reaksiyon mekanizması
- Geçici kinetik izotop fraksiyonasyonu
Referanslar
daha fazla okuma
- Bell RP, Crooks JE (20 Temmuz 1965). "Bazı Ketonik Maddelerin İyonizasyonunda Kinetik Hidrojen İzotop Etkileri". Londra A Royal Society of Proceedings . 286 (1406): 285–299. Bibcode : 1965RSPSA.286..285B . doi : 10.1098/rspa.1965.0144 .

![{\displaystyle {\begin{matrix}\\{\ce {{CN^{-}}+{^{12}CH3-Br}->[k_{12}]{^{12}CH3-CN}+ Br^{-}}}\\{\ce {{CN^{-}}+{^{13}CH3-Br}->[k_{13}]{^{13}CH3-CN}+Br^ {-}}}\\{}\end{matrix}}\qquad {\text{KIE}}={\frac {k_{12}}{k_{13}}}=1.082\pm 0,008}](https://wikimedia.org/api/rest_v1/media/math/render/svg/438109ea220fd190ccc57f3e2c3726c47c24aae0)




![{\displaystyle {\frac {k_{{\ce {H}}}}}{k_{{\ce {D}}}}}=\left({\frac {\sigma _{{\ce {H}}) }\sigma _{{\ce {D}}}^{\ddagger }}{\sigma _{{\ce {D}}}\sigma _{{\ce {H}}}^{\ddagger }} }\sağ)\sol({\frac {M_{{\ce {H}}}^{\ddagger }M_{{\ce {D}}}}}{M_{{\ce {D}}}^{ \ddagger }M_{{\ce {H}}}}}\sağ)^{\frac {3}{2}}\sol({\frac {I_{x{\ce {H}}}^{\ ddagger }I_{y{\ce {H}}}^{\ddagger }I_{z{\ce {H}}}^{\ddagger }}{I_{x{\ce {D}}}^{\ ddagger }I_{y{\ce {D}}}^{\ddagger }I_{z{\ce {D}}}^{\ddagger }}}{\frac {I_{x{\ce {D}} }I_{y{\ce {D}}}I_{z{\ce {D}}}}{I_{x{\ce {H}}}I_{y{\ce {H}}}I_{z {\ce {H}}}}}\sağ)^{\frac {1}{2}}\left({\frac {\prod \limits _{i=1}^{3N^{\ddagger }- 7}{\frac {1-e^{-u_{i{\ce {D}}}^{\ddagger }}}}{1-e^{-u_{i{\ce {H}}}^{ \ddagger }}}}}{\prod \limits _{i=1}^{3N-6}{\frac {1-e^{-u_{i{\ce {D}}}}}}{1- e^{-u_{i{\ce {H}}}}}}}\sağ)e^{-{\frac {1}{2}}\sol[\sum \limits _{i=1} ^{3N^{\ddagger }-7}(u_{i{\ce {H}}}^{\ddagger }-u_{i{\ce {D}}}^{\ddagger })-\sum \ sınırlar _{i=1}^{3N-6}(u_{i{\ce {H}}}-u_{i{\ce {D}}})\doğru]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/93f26faede9d0fba35d6f675e641c716e7284c0d)




![{\displaystyle {\begin{hizalanmış}{\frac {k_{{\ce {H}}}}{k_{{\ce {D}}}}}&\cong \exp \left\{-{\frac {1}{2}}\left[\sum \limits _{i=1}^{3N^{\ddagger }-7}(u_{i{\ce {H}}}^{\ddagger }-u_ {i{\ce {D}}}^{\ddagger })-\sum \limits _{i=1}^{3N-6}(u_{i{\ce {H}}}-u_{i{ \ce {D}}})\sağ]\sağ\}\\&\cong \exp \sol[\sum _{i}^{\mathrm {(tepki.)} }{\frac {1}{2 }}\Delta u_{i}-\sum _{i}^{\mathrm {(TS)} }{\frac {1}{2}}\Delta u_{i}^{\ddagger }\right]\ bitiş{hizalı}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/20d669d624e10fcb89d116442c5543998ea4fbf8)























![{\frac {d[A]}{dt}}={\frac {k_{1}k_{3}[ABCD]}{k_{2}[D]+k_{3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f71c52221df559ae3b305086cf125e2cfbfa62c4)
![{\frac {d[A]}{dt}}=k_{1}[ABCD]](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cfaea2beb4c13e320a49b4f66ede1c5a85d0fba)
![{\frac {d[A]}{dt}}={\frac {k_{1}k_{3}[ABCD]}{k_{2}[D]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea50a8acf1a1307f4d9c2b4605f62578e2f79771)
![{\displaystyle {\begin{aligned}{\ce {{A1}+{B}+{C}+\cdots }}\ &{\ce {->[k_{1}]P1}}\\{\ ce {{A2}+{B}+{C}+\cdots }}\ &{\ce {->[k_{2}]P2}}\end{hizalı}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8a3e1c66994bddc0e6b39e89f23e4e0ec7a47b5c)

![{\displaystyle {\text{oran}}={-d[{\ce {A}}_{n}] \over dt}=k_{n}\times [{\ce {A}}_{n} ]\times f([{\ce {B}}],[{\ce {C}}],\cdots ){\text{ burada }}n=1{\text{ veya }}2}](https://wikimedia.org/api/rest_v1/media/math/render/svg/26ca6ed80abd2295998fb23de5de165477f2848e)
![{\displaystyle {1 \over k_{1}}\times {\ce {{\mathit {d}}[A1] \over [A1]}}={1 \over k_{2}}\times {\ce {{\mathit {d}}[A2] \üzer [A2]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec95ce0a836f8db29e8a86da2d3a2390214f462c)
![{\displaystyle {1 \over k_{1}}\times \int \limits _{\ce {[A1]^{0}}}^{\ce {[A1]}}{d[{\ce {A }}'_{1}] \over [{\ce {A}}'_{1}]}={1 \over k_{2}}\times \int \limits _{\ce {[A2]^ {0}}}^{\ce {[A2]}}{d[{\ce {A}}'_{2}] \over [{\ce {A}}'_{2}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8b3f5c1311b00398d60afa93ae27d58ac423fd32)
![{\displaystyle {k_{1} \over k_{2}}={\frac {\ce {\ln([A1]/[A1]^{0})}}{\ce {\ln([A2] /[A2]^{0})}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a4f8b9f334d8799e9e6fc51d105e53d0148086f1)


![{\displaystyle {\text{KIE}}={\frac {k_{1}}{k_{2}}}={\frac {\ln(1-F_{1})}{\ln[(1- F_{1})R/R_{0}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9f819291ca2e6641dfaf1a2d31025c40927bdd7a)
![{\displaystyle {R \over R_{0}}={\ce {{\frac {[A2]/[A1]}{[A2]^0/[A1]^0}}}}={\ce { {\frac {[A2]/[A2]^0}{[A1]/[A1]^0}}}}={\frac {1-F_{2}}{1-F_{1}}}= (1-F_{1})^{(k_{2}/k_{1})-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/61529d236e7c75ed167c0a1e43f996134b54b908)

![{k_{1} \over k_{2}}={\frac {\ln(1-F_{1})}{\ln[1-(F_{1}R_{P}/R_{0})] }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/37f721659b133bfa69404286f90a8309fea92944)