Glutatyon S -transferaz -Glutathione S-transferase
| Glutatyon S -transferaz | |||||||||
|---|---|---|---|---|---|---|---|---|---|
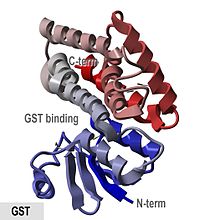 Anopheles cracens kaynaklı glutatyon S- transferazın kristalografik yapısı .
| |||||||||
| tanımlayıcılar | |||||||||
| AB numarası | 2.5.1.18 | ||||||||
| CAS Numarası. | 50812-37-8 | ||||||||
| veritabanları | |||||||||
| IntEnz | IntEnz görünümü | ||||||||
| BRENDA | BRENDA girişi | ||||||||
| ExPASy | NiceZyme görünümü | ||||||||
| fıçı | Fıçı girişi | ||||||||
| MetaCyc | metabolik yol | ||||||||
| PRİAM | profil | ||||||||
| PDB yapıları | RCSB PDB PDBe PDB toplamı | ||||||||
| Gen ontolojisi | AmiGO / QuickGO | ||||||||
| |||||||||
Önceden ligandinler olarak bilinen glutatyon S- transferazları ( GST'ler ), en iyi detoksifikasyon amacıyla glutatyonun (GSH) indirgenmiş formunun ksenobiyotik substratlara konjugasyonunu katalize etme yetenekleriyle bilinen ökaryotik ve prokaryotik faz II metabolik izozimlerin bir ailesidir. . : GST familyası üç üst-oluşmaktadır sitosolik , mitokondriyal ve mikrozomal -Ayrıca olarak bilinen MAPEG - proteinleri . GST süper ailesinin üyeleri, amino asit dizisinde son derece çeşitlidir ve halka açık veri tabanlarında depolanan dizilerin büyük bir bölümünün işlevi bilinmemektedir. Enzim Fonksiyonu Girişimi (EFI) yeni GST fonksiyonlarını belirlemek için üst familyası bir model olarak GST kullanıyor.
GST'ler, bazı memeli organlarında sitozolik proteinin %10'una kadarını oluşturabilir. GST'ler, bileşikleri suda daha çözünür hale getirmek için, bir sülfhidril grubu aracılığıyla, çok çeşitli substratlar üzerindeki elektrofilik merkezlere GSH'nin konjugasyonunu katalize eder. Bu aktivite peroksitlenmiş lipidler gibi endojen bileşikleri detoksifiye eder ve ksenobiyotiklerin parçalanmasını sağlar. GST'ler ayrıca toksinleri bağlayabilir ve GST'ler için erken terim olan ligandin'e yol açan taşıma proteinleri olarak işlev görebilir .
sınıflandırma
| Glutatyon S- transferaz, C- terminal alanı | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Sıçan glutatyon ksenobiyotik substrat bağlanma yeri yapısı S GSH adüktü bağlı -Transferase mu 1 fenantren -9,10-oksit.
| |||||||||
| tanımlayıcılar | |||||||||
| Sembol | GST_C | ||||||||
| Pfam | PF00043 | ||||||||
| InterPro | IPR004046 | ||||||||
| SCOP2 | 2gst / KAPSAM / SUPFAM | ||||||||
| OPM süper ailesi | 178 | ||||||||
| OPM proteini | 5i9k | ||||||||
| CDD | cd00299 | ||||||||
| |||||||||
Protein dizisi ve yapısı, GST'lerin üç üst ailesi (sitosolik, mitokondriyal ve MAPEG) için önemli ek sınıflandırma kriterleridir : GST'lerin sitozolik üst ailesinden gelen sınıflar %40'tan fazla dizi benzerliğine sahipken, diğer sınıflardan olanlar %25'ten daha az olabilir. . Sitosolik GST'ler yapılarına göre 13 sınıfa ayrılır: alfa, beta, delta, epsilon, zeta, teta, mu, nu, pi, sigma, tau, phi ve omega. Mitokondriyal GST'ler kappa sınıfındadır. Mikrozomal GST'lerin MAPEG süper ailesi, aralarında amino asit dizilerinin %20'den az özdeşliği paylaştığı , I-IV olarak adlandırılan alt gruplardan oluşur . İnsan sitozolik GST'leri alfa, zeta, teta, mu, pi, sigma ve omega sınıflarına aitken, MAPEG süper ailesinin I, II ve IV sınıflarına ait altı izozimin var olduğu bilinmektedir.
isimlendirme
İlk olarak 1992'de önerilen standartlaştırılmış GST terminolojisi, ilgili izozimin ait olduğu türleri, GST kısaltmasından önce gelen küçük harfli bir baş harfle (örneğin, insan için "h") tanımlar. İzozim sınıfı daha sonra bir büyük harfle (örneğin, alfa için "A") ve ardından sınıf alt ailesini (veya alt birimini) temsil eden bir Arap rakamıyla tanımlanır . Hem mitokondriyal hem de sitozolik GST'ler dimerler olarak mevcut olduğundan ve aynı sınıfın üyeleri arasında yalnızca heterodimerler oluştuğundan, enzim dimerinin ikinci alt ailesi bileşeni bir tire ile gösterilir ve ardından ek bir Arap rakamı gelir. Bu nedenle, bir insan glutatyon S- transferazı, pi-sınıfı alt ailesi 1'de bir homodimer ise, adı "hGSTP1-1" olarak yazılacaktır.
GST'ler için erken adlandırma, Sephadex G75 kromatografisi kullanılarak "Y" fraksiyonunda ("X ve Z" fraksiyonlarının aksine) ayrılmalarına atıfta bulunarak onlara "Y" proteinleri olarak atıfta bulundu. GST alt birimleri tanımlandığından, gerekirse monomer izoformunu tanımlayan bir sayı (örn. Yb1) ile Ya, Yp, vb. olarak adlandırıldılar. Litwack ve arkadaşları , daha önce “Y” proteinleri olarak bilinen proteinleri kapsayacak şekilde “Ligandin” terimini önerdiler.
Klinik kimya ve toksikolojide en yaygın olarak alfa GST, mu GST ve pi GST terimleri kullanılır.
Yapı
| tanımlayıcılar | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Sembol | GST_N | ||||||||
| Pfam | PF02798 | ||||||||
| Pfam klanı | CL0172 | ||||||||
| InterPro | IPR004045 | ||||||||
| PROZİT | PS50404 | ||||||||
| SCOP2 | 1g7o / KAPSAM / SUPFAM | ||||||||
| |||||||||
Glutatyon bağlanma bölgesi veya "G-sitesi", hem sitozolik hem de mitokondriyal GST'lerin tioredoksin benzeri alanında bulunur. Çeşitli sınıflar arasında en fazla değişkenliği içeren bölge , üç farklı amino asit kalıntısından birinin glutatyonun glisin kalıntısı ile etkileşime girdiği sarmal a2 bölgesidir . Sitosolik GST'lerin iki alt grubu, glutatyon ile etkileşimlerine dayalı olarak karakterize edilmiştir: glutatyonu aktive etmek için bir tirozin kalıntısı kullanan Y-GST grubu ve bunun yerine serin veya sistein kalıntılarını kullanan S/C-GST .
- "GST proteinleri, bir N- terminali karışık sarmal ve beta-iplik alanı ve bir tamamen sarmal C - terminali alanına sahip küresel proteinlerdir ."
Domuz pi sınıf enzimi pGTSP1-1 yapısı tespit için ilk GST oldu ve bir ihtiva süper ailesinin sitosolik GST diğer üyeleri için temsili tiyoredoksin-benzeri N -terminal hem de bir şekilde etki Cı -terminal alanı oluşan alfa sarmalları .
Memeli sitozolik GST'leri dimeriktir , her iki alt birim de aynı GST sınıfındandır, ancak mutlaka aynı değildir. Monomerler boyutu yaklaşık 25 kDa olan. Önemli ölçüde örtüşen çok çeşitli alt tabakalar üzerinde aktiftirler. Aşağıdaki tablo , UniProtKB/Swiss-Prot veritabanında bulunduğu gibi, Homo sapiens'te var olduğu bilinen her sınıfın tüm GST enzimlerini listeler .
| GST Sınıfı | Homo sapiens GST Sınıfı Üyeleri (22) |
|---|---|
| Alfa | GSTA1 , GSTA2 , GSTA3 , GSTA4 , GSTA5 |
| Delta | |
| Kappa | GSTK1 |
| Mü | GSTM1 , GSTM1L (RNAi) , GSTM2 , GSTM3 , GSTM4 , GSTM5 |
| Omega | GSTO1 , GSTO2 |
| Pi | GSTP1 |
| teta | GSTT1 , GSTT2 , GSTT4 |
| Zeta | GSTZ1 (diğer adıyla MAAI-Maleylacetoasetat izomeraz) |
| mikrozomal | MGST1 , MGST2 , MGST3 |
Evrim
Doğal toksinler tarafından Çevre meydan hazırlamak için yardımcı Drosophilae için DDT , meydan
İşlev
GST'lerin aktivitesi, gama-glutamilsistein sentetaz ve glutatyon sentetaz sentetik enzimlerinden sürekli bir GSH kaynağına ve ayrıca spesifik taşıyıcıların GSH konjugatlarını hücreden uzaklaştırma etkisine bağlıdır. GST'lerin birincil rolü, söz konusu polar olmayan ksenobiyotik substratların elektrofilik karbon, kükürt veya nitrojen atomları üzerinde GSH tarafından nükleofilik saldırıyı katalize ederek ksenobiyotikleri detoksifiye etmek ve böylece önemli hücresel proteinler ve nükleik asitlerle etkileşimlerini önlemektir. Spesifik olarak, GST'lerin bu roldeki işlevi iki yönlüdür: hem enzimin hidrofobik H-bölgesindeki substratı hem de birlikte enzimin aktif bölgesini oluşturan bitişik hidrofilik G-bölgesindeki GSH'yi bağlamak ; ve ardından substrat üzerinde nükleofilik saldırıyı sağlayan GSH'nin tiyol grubunu aktive etmek . Glutatyon molekülü, N- ve C- terminal alanları arasındaki bir yarıkta bağlanır - katalitik olarak önemli kalıntıların N- terminal alanında kalması önerilir . Doğada hetero- veya homodimerik olsun, GST dimerinin her iki alt birimi, tek bir substrat olmayan bağlanma yerinin yanı sıra bir GSH bağlama bölgesi içerir. Bununla birlikte, sitozolik mu ve alfa sınıfları tarafından oluşturulanlar gibi heterodimerik GST komplekslerinde, iki alt birim arasındaki yarık, enzimlerin heterodimer oluşturma yeteneğini açıklayabilen, ek bir yüksek afiniteli substrat dışı ksenobiyotik bağlanma bölgesine ev sahipliği yapar.
GST'ler tarafından bu şekilde hedeflenen bileşikler, kemoterapötik ajanlar ve diğer ilaçlar, pestisitler, herbisitler, kanserojenler ve değişken türevli epoksitler dahil olmak üzere çok çeşitli çevresel veya başka şekilde eksojen toksinleri kapsar; Gerçekten de, GST'ler β konjügasyonu sorumludur 1 -8,9-epoksit, oluşturulmuş bir reaktif ara aflatoksin B 1 kemirgenlerde toksine karşı bir koruma önemli bir araçtır. Detoksifikasyon reaksiyonları, substratları daha çözünür hale getirmeye hizmet eden ve çoklu ilaç direnci ile ilişkili protein 1 ( MRP1 ) gibi taşıyıcılar tarafından hücreden uzaklaştırılmasına izin veren GSH'ye konjugasyon ile merkapturik asit sentezinin ilk dört adımını içerir . İhracattan sonra, konjugasyon ürünleri merkapturik asitlere dönüştürülür ve idrar veya safra yoluyla atılır .
Memeli izoenzimlerinin çoğu, 1-kloro-2,4-dinitrobenzen substratı için afiniteye sahiptir ve bu substratı kullanan spektrofotometrik testler, GST aktivitesini bildirmek için yaygın olarak kullanılır. Ancak bazı endojen bileşikler, örneğin bilirubin, GST'lerin aktivitesini inhibe edebilir. Memelilerde, GST izoformları hücreye özgü dağılımlara sahiptir (örneğin, hepatositlerde α-GST ve insan karaciğerinin safra yollarında π-GST).
GST'ler, klopidogrel ön ilacının biyoaktivasyon sürecinde bir role sahiptir .
Hücre sinyalleşmesindeki rolü
Ksenobiyotikleri GSH'ye konjuge etme ve böylece hücresel ortamları detoksifiye etme yetenekleriyle en iyi bilinmesine rağmen, GST'ler ayrıca önemli hücre sinyalleme etkileri ile substrat olmayan ligandları bağlayabilir . Çeşitli sınıflardan birkaç GST izoziminin, hücre proliferasyonunu ve ölümünü düzenleyen MAPK yolunda yer alan bir kinazın işlevini inhibe ettiği, kinazın sinyalleşme kaskadının kolaylaştırılmasındaki rolünü yerine getirmesini engellediği gösterilmiştir.
Memeli GST ailesinin iyi karakterize edilmiş bir izozimi olan sitozolik GSTP1-1, esas olarak kalp, akciğer ve beyin dokularında eksprese edilir; aslında, karaciğer dışında ifade edilen en yaygın GST'dir. İnsan tümör hücre hatlarının çoğunda aşırı ekspresyonuna ve kemoterapötik dirençli tümörlerdeki prevalansına dayanarak, GSTP1-1'in kanser gelişiminde ve ilaç tedavisine potansiyel direncinde rol oynadığı düşünülmektedir . Bunun için daha başka kanıtlar, bilgiden gelen GSTP seçici önleyebilen Cı -Jun tarafından fosforilasyonu , JNK apoptozun önlenmesi. Düşük hücresel stres zamanlarında, GSTP ve JNK'nin C- terminali arasındaki doğrudan protein-protein etkileşimleri yoluyla bir kompleks oluşur ve JNK'nin etkisini ve dolayısıyla JNK yolunun indüklenmesini etkili bir şekilde önler. Hücresel oksidatif stres , kompleksin ayrışmasına, GSTP'nin oligomerizasyonuna ve JNK yolunun indüklenmesine neden olarak apoptoz ile sonuçlanır . Proapoptotik JNK yolunun GSTP inhibisyonu ile ilaca dirençli tümör hücrelerinde izozimin aşırı ekspresyonu arasındaki bağlantı, tümör hücrelerinin GSTP'nin substratları olmayan ilaçların aracılık ettiği apoptozdan kaçma kabiliyetini açıklayabilir.
GSTP gibi, GSTM1 de doğrudan protein-protein etkileşimleri yoluyla apoptotik yolakları düzenlemede yer alır, ancak JNK'nin yukarı akışındaki ASK1 üzerinde etki eder . Mekanizma ve sonuç, GSTP ve JNK'ninkine benzerdir, çünkü GSTM1 kompleks oluşumu yoluyla ASK1'i sekestre eder ve MAPK sinyalleme kaskadının proapoptotik p38 ve JNK kısımlarının indüklenmesini önler . GSTP gibi, GSTM1, oksidatif stresin yokluğunda partneri ile etkileşime girer, ancak ASK1 de ASK1 sekestrasyonu sırasında aynı şekilde önlenen ısı şoku tepkisine dahil olur . Yüksek GST seviyelerinin, kemoterapötik ajanlar da dahil olmak üzere bir dizi madde tarafından indüklenen apoptoza direnç ile ilişkili olması, MAPK sinyallemesinin önlenmesindeki varsayılan rolünü destekler.
Kanser gelişiminde etkileri
GST'nin, özellikle GSTP'nin kanser gelişimi ve kemoterapötik dirençteki rolünü destekleyen artan sayıda kanıt vardır. GSTP ve kanser arasındaki bağlantı, birçok kanserde GSTP'nin aşırı ekspresyonunda en belirgindir, ancak aynı zamanda, tümör hücrelerinin dönüştürülmüş fenotipinin, anormal şekilde düzenlenmiş kinaz sinyal yolları ve aşırı eksprese edilen proteinlere hücresel bağımlılık ile ilişkili olduğu gerçeğiyle de desteklenir. Çoğu anti-kanser ilacının GSTP için zayıf substratlar olması, birçok tümör hücre hattında yüksek GSTP'nin rolünün bileşikleri detoksifiye etmek olmadığını, ancak başka bir amacı olması gerektiğini gösterir; Bu hipotez, ilaca dirençli olmayan tümör hücre dizilerinde GSTP aşırı ekspresyonunun yaygın bulgusu ile de desteklenmektedir.
Klinik önemi
Kanser gelişimi ve kemoterapötik ilaç direncindeki rollerine ek olarak, GST'ler, GSH ile katılımları nedeniyle çeşitli hastalıklarda rol oynar. Alfa, mu, pi ve teta sınıflarının GST polimorfizmlerinin çeşitli kanser türlerine duyarlılık üzerindeki etkisine ilişkin kanıtlar çok az olsa da , çok sayıda çalışma astım , ateroskleroz , alerjiler ve diğer inflamatuar hastalıklardaki bu tür genotipik varyasyonları ortaya çıkarmıştır .
Çünkü diyabet oksidatif hasara önemli bir hastalıktır ve GSH metabolizması diyabetli hastalarda işlevsel olduğu, GST'ler diyabetik ilaç tedavisi için potansiyel bir hedef olabilir. Ek olarak, insülin uygulamasının PI3K/AKT/mTOR yolu yoluyla GST gen ekspresyonunun artmasına ve hücre içi oksidatif stresin azalmasına neden olduğu , glukagonun ise bu tür gen ekspresyonunu azalttığı bilinmektedir .
Omega sınıfı GST (GSTO) genleri özellikle Alzheimer , Parkinson ve amyotrofik lateral skleroz gibi nörolojik hastalıklarla ilişkilidir ; yine, oksidatif stresin suçlu olduğuna inanılmaktadır ve GSTO gen ekspresyonunda azalma, hastalıkların başlangıç yaşının düşmesine neden olmaktadır.
Organ hasarının bir göstergesi olarak GST'lerin salınımı
GST'lerin yüksek hücre içi konsantrasyonları, hücreye özgü hücresel dağılımlarıyla birleştiğinde, tanımlanmış hücre tiplerindeki hasarı lokalize etmek ve izlemek için biyobelirteçler olarak işlev görmelerini sağlar. Örneğin, hepatositler yüksek düzeyde alfa GST içerir ve serum alfa GST'nin transplantasyon , toksisite ve viral enfeksiyonlarda hepatosit hasarının bir göstergesi olduğu bulunmuştur .
Benzer şekilde insanlarda renal proksimal tübüler hücreler yüksek konsantrasyonlarda alfa GST içerirken distal tübüler hücreler pi GST içerir. Bu spesifik dağılım, transplantasyon , nefrotoksisite ve iskemik hasarda renal tübüler hasarı ölçmek ve lokalize etmek için üriner GST'lerin ölçülmesini sağlar .
Kemirgen öncesi klinik çalışmalarda, idrar ve serum alfa GST'nin, sırasıyla renal proksimal tübüler ve hepatosit nekrozunun duyarlı ve spesifik göstergeleri olduğu gösterilmiştir.
GST etiketleri ve GST aşağı açılan tahlili
GST, bir aşağı çekme tahlili olarak bilinen bir işlemde çözeltiden saflaştırmak için ilgilenilen bir proteine eklenebilir . Bu, ilgili proteini kodlayanın yanına GST DNA kodlama dizisi eklenerek gerçekleştirilir. Böylece, transkripsiyon ve translasyondan sonra, GST proteini ve ilgili protein, bir füzyon proteini olarak birlikte ifade edilecektir . GST proteini, GSH için güçlü bir bağlanma afinitesine sahip olduğundan, bileşik ile kaplanmış boncuklar protein karışımına eklenebilir; sonuç olarak, GST'ye bağlanan ilgili protein, proteini solüsyondakilerin geri kalanından izole ederek boncuklara yapışacaktır. Boncuklar geri kazanılır ve ilgili proteini boncuklardan ayırmak için serbest GSH ile yıkanır, bu da saflaştırılmış bir protein ile sonuçlanır. Bu teknik, doğrudan protein-protein etkileşimlerini aydınlatmak için kullanılabilir. Bu tahlilin bir dezavantajı, ilgilenilen proteinin doğal durumunu değiştirerek GST'ye bağlanmasıdır.
GST füzyon proteini içeren proteinleri ayırmak ve saflaştırmak için genellikle bir GST etiketi kullanılır. Etiketin boyutu 220 amino asittir (kabaca 26 kDa), bu, Myc etiketi veya FLAG etiketi gibi etiketlerle karşılaştırıldığında oldukça büyüktür. Bir proteinin N- ucuna veya C- ucuna kaynaştırılabilir . Bununla birlikte, ticari olarak temin edilebilen birçok GST etiketli plazmit kaynağı, protein saflaştırması sırasında GST etiketinin bölünmesi için bir trombin bölünme bölgesini içerir.
Ayrıca bakınız
- Afinite kromatografisi
- Bakteriyel glutatyon transferaz
- Glutatyon S- transferaz Mu 1
- Glutatyon S- transferaz, C- terminal alanı
- GSTP1
- Maltoz bağlayıcı protein
- Protein etiketi
Referanslar
Düşük ve diğerleri 2007
- Düşük, Wai Yee; Ng, Hooi Ling; Morton, Craig J.; Parker, Michael W.; Batterham, Philip; Robin, Charles (2007). " Drosophila Cinsinde Glutatyon S-Transferazların Moleküler Evrimi " . Genetik . Amerika Genetik Derneği / Oxford University Press (OUP). 177 (3): 1363-1375. doi : 10.1534/genetics.107.075838 . ISSN 0016-6731 . PMC 2147980 . PMID 18039872 .

