Parkinson hastalığı - Parkinson's disease
| Parkinson hastalığı | |
|---|---|
| Diğer isimler | Parkinson hastalığı, idiyopatik veya primer parkinsonizm, hipokinetik rijit sendrom, felç ajitanları, titreme felci |
 | |
| İlk olarak Sinir Sistemi Hastalıkları El Kitabı'nda (1886) yayınlanan William Richard Gowers tarafından yapılan Parkinson hastalığının çizimi | |
| uzmanlık | Nöroloji |
| Belirtiler | Tremor , rijidite , hareketin yavaşlığı , yürüme güçlüğü |
| komplikasyonlar | Demans , depresyon , anksiyete |
| Her zamanki başlangıç | 60 yaş üstü |
| nedenler | Bilinmeyen |
| Risk faktörleri | Pestisit maruziyeti, kafa yaralanmaları |
| teşhis yöntemi | Semptomlara dayalı |
| Ayırıcı tanı | Lewy cisimcikli demans , ilerleyici supranükleer felç , esansiyel tremor , antipsikotik kullanımı . |
| Tedavi | İlaçlar, ameliyat |
| İlaç tedavisi | L-DOPA , dopamin agonistleri |
| prognoz | Yaşam beklentisi yaklaşık 7-15 yıl |
| Sıklık | 6,2 milyon (2015) |
| Ölümler | 117.400 (2015) |
Parkinson hastalığı ( PD ), ya da sadece Parkinson , a, uzun süreli dejeneratif bozukluğu arasında , merkezi sinir sistemi esas olarak etkiler motor sistemi . Semptomlar genellikle yavaş ortaya çıkar ve hastalık kötüleştikçe motor dışı semptomlar daha yaygın hale gelir. En belirgin erken belirtiler titreme , rijidite , hareketlerde yavaşlama ve yürüme güçlüğüdür . PD'li birçok insanda ortaya çıkan depresyon , anksiyete ve ilgisizlik ile bilişsel ve davranışsal sorunlar da ortaya çıkabilir . Parkinson hastalığı demansı , hastalığın ileri evrelerinde yaygın hale gelir. Parkinson hastaları da uyku ve duyu sistemlerinde problem yaşayabilirler . Hastalığa sonucu motor semptomları hücrelerin ölümü olarak substantia nigra , bir bölgesi orta beyin bir yol, dopamin açığı. Bu hücre ölüm sebebi tam olarak anlaşılamamıştır, fakat birikim yaptığı ait müdahalesi içermez yanlış katlanmış proteinler içine Lewy organları içinde nöronlar . Toplu olarak, ana motor semptomlar parkinsonizm veya parkinson sendromu olarak da bilinir .
PD'nin nedeni bilinmemektedir , hem kalıtsal hem de çevresel faktörlerin rol oynadığına inanılmaktadır. PD'den etkilenen bir aile üyesi olanlar, kalıtsal risk faktörleri olarak bilinen belirli genlerle hastalığa yakalanma riski altındadır. Diğer risk faktörleri, belirli pestisitlere maruz kalmış ve önceden kafa travması geçirmiş kişilerdir . Kahve içenler, çay içenler ve sigara içenler daha az risk altındadır.
Tipik vakaların teşhisi esas olarak semptomlara dayanır ve motor semptomlar başlıca şikayettir. Gibi testler beyin ( manyetik rezonans görüntüleme olarak bilinen dopamin nöronal disfonksiyon bakmak için veya görüntüleme DAT tarama ) diğer hastalıklar üzerinden yardım kuralı için kullanılabilir. Parkinson hastalığı tipik olarak 60 yaşın üzerindeki kişilerde görülür ve bunların yaklaşık yüzde biri etkilenir. Erkekler yaklaşık 3:2 oranında kadınlardan daha sık etkilenir. 50 yaşından önce kişilerde görüldüğünde erken başlangıçlı PD olarak adlandırılır. 2015 yılına kadar PD 6,2 milyon insanı etkiledi ve dünya çapında yaklaşık 117.400 ölümle sonuçlandı. Tanıyı takiben ortalama yaşam beklentisi 7 ila 15 yıl arasındadır.
PD için bir tedavi bilinmemektedir; Tedavi semptomların etkilerini azaltmayı amaçlar. İlk tedavi tipik olarak levodopa ( L-DOPA ), MAO-B inhibitörleri veya dopamin agonistleri ilaçları ile yapılır . Hastalık ilerledikçe, bu ilaçlar daha az etkili hale gelirken aynı zamanda istemsiz kas hareketleriyle belirgin bir yan etki yaratır . Bu sırada ilaçlar kombinasyon halinde kullanılabilir ve dozlar arttırılabilir. Diyet ve belirli rehabilitasyon biçimleri, semptomları iyileştirmede bir miktar etkililik göstermiştir. Derin beyin stimülasyonu için mikroelektrot yerleştirme ameliyatı , ilaçların etkisiz olduğu ciddi vakalarda motor semptomları azaltmak için kullanılmıştır. Uyku bozuklukları ve duygusal problemler gibi PD'nin hareketle ilgili olmayan semptomlarına yönelik tedaviler için kanıtlar daha az güçlüdür.
Hastalığın adını , 1817'de An Essay on the Shaking Palsy'de ilk ayrıntılı açıklamayı yayınlayan İngiliz doktor James Parkinson'dan almıştır. Halkı bilinçlendirme kampanyaları arasında Dünya Parkinson Günü (James Parkinson'un doğum günü, 11 Nisan) ve bir hastalığın sembolü olarak kırmızı lale . Halkın bu duruma ilişkin farkındalığını artıran PD'li kişiler arasında boksör Muhammed Ali , aktör Michael J. Fox , Olimpiyat bisikletçisi Davis Phinney ve aktör Alan Alda yer alıyor .
sınıflandırma
Parkinson hastalığı, parkinsonizmin en yaygın şeklidir ve bazen " idyopatik parkinsonizm" olarak adlandırılır , bu da tanımlanabilir bir nedeni olmayan parkinsonizm anlamına gelir. Bilim adamları bazen PD'ye , beyindeki protein alfa-sinükleinin anormal birikimi nedeniyle sinükleinopati adı verilen bir tür nörodejeneratif hastalık olarak atıfta bulunurlar . Sinükleinopati sınıflandırması, onu , beynin tau proteini olarak bilinen farklı bir protein biriktirdiği Alzheimer hastalığı gibi diğer nörodejeneratif hastalıklardan ayırır .
Tauopatiler ve sinükleinopatiler arasında önemli klinik ve patolojik örtüşmeler vardır , ancak farklılıklar mevcuttur. PD'nin aksine, Alzheimer hastalığı olan kişiler en sık hafıza kaybı yaşarlar. PD'nin ana belirtileri (yavaşlık, titreme, sertlik ve postural instabilite) Alzheimer'ın normal özellikleri değildir.
PD'yi başlangıç yaşı, semptomların ilerlemesi ve tremorun baskınlığına odaklanarak farklı alt tiplere sınıflandırmak için girişimlerde bulunuldu, ancak hiçbiri benimsenmedi.
Belirti ve bulgular
PD'deki en tanınabilir semptomlar hareket ("motor") ile ilgilidir. Otonom disfonksiyon, nöropsikiyatrik problemler (ruh hali, biliş, davranış veya düşünce değişiklikleri) ve duyusal (özellikle koku alma duyusunda değişiklik) ve uyku güçlüklerini içeren motor olmayan semptomlar da yaygındır. Bu motor olmayan semptomların bazıları tanı anında mevcut olabilir.
Motor
PD'de dört motor semptom ana işaret olarak kabul edilir : tremor, hareket yavaşlığı (bradikinezi), rijidite ve postural instabilite.
En sık görülen belirti, etkilenen kolun istemli hareketi sırasında ve uykunun daha derin aşamalarında kaybolan, dinlenme halindeki elin kaba, yavaş titremesidir . Tipik olarak sadece bir elde görülür ve sonunda hastalık ilerledikçe iki eli de etkiler. PD titremesinin frekansı 4 ila 6 hertz arasındadır (saniyedeki devir sayısı). Tremorun bir özelliği de "hap yuvarlama", işaret parmağı ve başparmağın birbirine dokunma ve dairesel bir hareketle birlikte hareket etme eğilimidir. Terim, PD'li kişilerin hareketi ile elle hap yapma erken farmasötik tekniği arasındaki benzerlikten türemiştir.
Bradikinezi , her PD vakasında bulunur ve hareketin başlatılmasının motor planlamasındaki bozukluklardan kaynaklanır ve bir hareketin planlanmasından başlatılmasına ve yürütülmesine kadar tüm hareket süreci boyunca zorluklarla ilişkilidir. Sıralı ve eşzamanlı hareketin performansı bozulur. Bradykinesia, Parkinson hastalığının en çok engelleyici semptomudur ve giyinme, beslenme ve banyo yapma gibi günlük işlerde zorluklara yol açar. Aynı anda iki bağımsız motor aktiviteyi gerçekleştirmede özellikle zorluğa yol açar ve duygusal stres veya eşzamanlı hastalıklar ile daha da kötüleşebilir. Paradoksal olarak, PD'li insanlar, düz bir zeminde yürümekten daha kolay bir şekilde bisiklete binebilir veya merdivenleri tırmanabilir. Çoğu doktor bradikineziyi kolayca fark edebilirken, resmi değerlendirme kişilerin parmakları ve ayaklarıyla tekrarlayan hareketler yapmasını gerektirir.
Sertlik , artan kas tonusu , aşırı ve sürekli kas kasılmasının neden olduğu uzuv hareketine sertlik ve dirençtir . Parkinsonizmde, sertlik "kurşun-boru sertliği" olarak bilinen tek tip veya "dişli çark sertliği" olarak bilinen cırcır-y olabilir. Titreme ve artan ton kombinasyonu, dişli çark sertliğinin kaynağı olarak kabul edilir. Sertlik eklem ağrısı ile ilişkili olabilir; bu tür ağrı, hastalığın sık görülen bir ilk belirtisidir. PD'nin erken evrelerinde, sertlik genellikle asimetriktir ve yüz ve ekstremite kaslarından önce boyun ve omuz kaslarını etkileme eğilimindedir. Hastalığın ilerlemesiyle birlikte, sertlik tipik olarak tüm vücudu etkiler ve hareket kabiliyetini azaltır.
Postural instabilite , hastalığın sonraki aşamalarında tipiktir ve denge bozukluğuna ve sık düşmelere ve ikincil olarak kemik kırıklarına , güven kaybına ve hareketliliğin azalmasına yol açar . Kararsızlık, özellikle genç insanlarda, özellikle iki taraflı semptomların gelişmesinden önce, ilk aşamalarda genellikle yoktur. Parkinson hastalığı teşhisi konan kişilerin %40'a kadarı düşmeler yaşayabilir ve yaklaşık %10'u haftalık olarak düşmeler yaşayabilir ve düşme sayısı PD'nin ciddiyetine bağlıdır.
Bilinen diğer motor belirti ve semptomlar, yürüyüş ve festinasyon gibi duruş bozukluklarını içerir (hızlı karıştırma adımları ve yürürken kol sallanmadan öne doğru bükülmüş bir duruş ). (Ayaklar özellikle çevirerek veya yönünü değiştirme hakkında, zemine takılıp görünmektedir zaman kısa tutuklamaları) yürümenin dondurulması, bir bozukluğu, monoton, sessiz ses, maske benzeri yüz ifadesi ve daha küçük ve küçülür el yazısı diğer ortak işaretler vardır .
nöropsikiyatrik
PD, hafif ila şiddetli arasında değişebilen nöropsikiyatrik rahatsızlıklara neden olabilir. Buna biliş, ruh hali, davranış ve düşünce bozuklukları dahildir.
Bilişsel bozukluklar, hastalığın erken evrelerinde ve bazen tanı öncesinde ortaya çıkabilir ve hastalığın süresi ile birlikte görülme sıklığı artar. PD'deki en yaygın bilişsel eksiklik, planlama, bilişsel esneklik , soyut düşünme, kural edinme, uygunsuz eylemleri engelleme , uygun eylemleri başlatma, çalışma belleği ve dikkat kontrolü ile ilgili sorunları içerebilen yürütücü işlev bozukluğudur . Diğer bilişsel zorluklar, yavaşlamış bilişsel işlem hızı , bozulmuş hatırlama ve bozulmuş algı ve zaman tahminini içerir. Bununla birlikte, hatırlama ipuçlarıyla desteklendiğinde iyileşme görülür. Görsel-uzaysal zorluklar da hastalığın bir parçasıdır, örneğin kişiden yüz tanıma testleri yapması ve çizilen çizgilerin yönünü algılaması istendiğinde görülür.
PD'li bir kişi, genel popülasyona kıyasla iki ila altı kat daha fazla bunama riskine sahiptir. Parkinson hastalığı olan kişilerin %78'inde bunama vardır. Demans prevalansı yaşla ve daha az derecede hastalığın süresiyle artar. Demans, PD'li kişilerde ve bakıcılarında düşük yaşam kalitesi , artan mortalite ve daha yüksek bakımevinde bakıma ihtiyaç duyma olasılığı ile ilişkilidir .
Patolojik kumar oynama, zorlayıcı cinsel davranış, aşırı yemek yeme, zorlayıcı alışveriş ve pervasız cömertlik dahil olmak üzere dürtü kontrol bozukluklarına ilaç, özellikle oral olarak aktif dopamin agonistleri neden olabilir. Dopamin disregülasyon sendromu - gereğinden fazla giden ilaç isteyen ile - levodopa kullanım nadir görülen bir komplikasyonudur.
Karmaşık, tekrarlayan, amaçsız, kalıplaşmış davranışların saatlerce meydana geldiği noktalama , Parkinson karşıtı ilaçların neden olduğu bir başka rahatsızlıktır.
Psikoz
Psikoz , yaygınlığı en geniş aralığı olan %26 ila %83 arasında değişen bir semptom olarak kabul edilebilir. Hastalık süresince Parkinson hastalarının yaklaşık %50'sinde halüsinasyonlar veya sanrılar görülür ve bunamanın ortaya çıkışını haber verebilir. Bunlar küçük halüsinasyonlardan - "geçiş hissi" (kişinin yanından hızla geçen bir şey) veya "mevcudiyet hissi" (kişinin hemen yanında veya arkasında duran bir şeyin/birinin algısı) - tam gelişmiş canlı, biçimlendirilmiş görsellere kadar uzanır. halüsinasyonlar ve paranoid düşünceler. PD'de işitsel halüsinasyonlar nadirdir ve nadiren ses olarak tanımlanır. Psikozun artık hastalığın ayrılmaz bir parçası olduğuna inanılıyor. Sanrılı ve buna bağlı deliryumlu bir psikoz, Parkinson karşıtı ilaç tedavisinin bilinen bir komplikasyonudur ve idrar yolu enfeksiyonlarından da kaynaklanabilir (sıklıkla kırılgan yaşlılarda görülür), ancak ilaçlar ve enfeksiyon tek faktör değildir ve altta yatan beyin nörotransmitterlerdeki veya reseptörlerindeki (örneğin asetilkolin, serotonin) patoloji veya değişikliklerin de PD'deki psikozda rol oynadığı düşünülmektedir.
Davranış ve ruh hali
Davranış ve duygudurum değişiklikleri, bilişsel bozukluğu olmayan PH'da genel popülasyona göre daha yaygındır ve genellikle demanslı PD'de bulunur. En sık görülen duygudurum güçlükleri depresyon , ilgisizlik ve kaygıdır .
Depresyonun, Parkinson hastalarının %20 ila %35'inde ortaya çıktığı ve hastalığın herhangi bir aşamasında ortaya çıktığı tahmin edilmektedir. Hastalık sürecinde yaygın olan semptomlarla (yorgunluk, uykusuzluk ve konsantrasyon güçlüğü) kendini gösterebilir ve bu da tanıyı zorlaştırır. Dopamin , serotonin ve noradrenerjik hormonlardaki dengesizlik ve değişikliklerin, PD'den etkilenen kişilerde depresyonun birincil nedeni olduğu bilinmektedir. Diğer bir neden, hastalığın neden olduğu fonksiyonel bozulmadır. Depresyon belirtileri ilgi kaybı, üzüntü, suçluluk, çaresizlik/umutsuzluk/suçluluk duyguları ve intihar düşüncesi içerebilir. PD'den etkilenen kişilerde intihar düşüncesi genel popülasyondan daha yüksektir, ancak intihar girişimlerinin kendileri, PD'si olmayan depresyonu olan kişilere göre daha düşüktür. PD'de depresyon için risk faktörleri arasında 50 yaşın altında hastalık başlangıcı, kadın olmak, önceki depresyon öyküsü, şiddetli motor semptomlar ve diğerleri sayılabilir.
Anksiyetenin PD'den etkilenen kişilerde genellikle %30-40 civarında bir yaygınlığa sahip olduğu tahmin edilmektedir (%60 bulunmuştur). Anksiyete genellikle "kapalı" dönemlerde (ilaçların daha önce olduğu kadar iyi çalışmadığı zamanlar) genel popülasyona kıyasla panik ataktan muzdarip PD'den etkilenen kişilerde bulunabilir. Hem anksiyete hem de depresyonun azalmış yaşam kalitesi ile ilişkili olduğu bulunmuştur. Semptomlar, anormal gama-aminobütirik asit seviyeleri ve semptomlar veya hastalık hakkında utanç veya korku gibi potansiyel nedenler ile hafif ve epizodik ila kronik arasında değişebilir . PD'de kaygı için risk faktörleri, 50 yaşın altında hastalık başlangıcı, kadınlar ve "kapalı" dönemlerdir.
Apati ve anhedoni , sırasıyla motivasyon kaybı ve zevk alma yeteneğinin bozulması olarak tanımlanabilir. Bunlar klasik olarak depresyonla ilişkili semptomlardır, ancak PD'den etkilenen kişilerde tedavi ve mekanizma bakımından farklılık gösterirler ve her zaman depresyonla ortaya çıkmazlar. Apati %16,5-40 civarında kendini gösterir. Kayıtsızlık belirtileri, yeni faaliyetlere veya çevrelerindeki dünyaya karşı inisiyatif/ilgi azalması, duygusal kayıtsızlık ve başkaları için sevgi veya ilgi kaybıdır. Apati, yürütücü ve sözel bellek dahil olmak üzere bilişsel işlevlerdeki eksikliklerle ilişkilidir.
Başka
Uyku bozuklukları hastalığın bir özelliğidir ve ilaçlarla daha da kötüleşebilir. Semptomlar gündüz uyuşukluk ( narkolepsiyi andıran ani uyku atakları dahil ), hızlı göz hareketi uykusunda bozukluklar veya uykusuzluk olarak ortaya çıkabilir . İnsanların rüyaları canlandırdığı, bazen kendilerini veya yatak partnerini yaraladığı REM davranış bozukluğu , PD veya Lewy cisimcikli demansın motor veya bilişsel özelliklerinin gelişmesinden yıllar önce başlayabilir .
Otonom sinir sistemindeki değişiklikler ortostatik hipotansiyona (ayaktayken düşük kan basıncı), yağlı cilde , aşırı terlemeye, idrar kaçırmaya ve cinsel işlevde değişikliğe neden olabilir. Kabızlık ve bozulmuş mide boşalması (gastrik dismotilite) rahatsızlığa neden olacak ve hatta sağlığı tehlikeye atacak kadar şiddetli olabilir. Algıdaki değişiklikler, koku alma duyusunda bozulma, görme bozukluğu, ağrı ve parestezi (karıncalanma ve uyuşma) içerebilir . Bu semptomların tümü, hastalığın teşhisinden yıllar önce ortaya çıkabilir.
nedenler
Bazen hastalığın olası mekanizmalarıyla ilgili teorilerle ilgili olarak birçok risk faktörü önerilmiştir; ancak hiçbiri kesin olarak kanıtlanamamıştır. En sık tekrarlanan ilişkiler, pestisitlere maruz kalanlarda artan risk ve sigara içenlerde azalan risktir. PD ve Helicobacter pylori enfeksiyonu arasında , levodopa dahil bazı ilaçların emilimini engelleyebilen olası bir bağlantı vardır .
Çevresel faktörler ve maruziyetler
Pestisitlere maruz kalma ve kafa travması öyküsü her biri PD ile bağlantılıdır, ancak riskler mütevazıdır. Asla kafeinli içecekler içmemek de PD geliştirme riskindeki küçük artışlarla ilişkilidir. Sigara içenlerin PD geliştirme riski daha düşük olmasına rağmen, tütün içiminin sağlık üzerinde ezici bir şekilde olumsuz etkileri vardır ve tütün kullanan kişilerin yarısı kadarı tütün kullanımının komplikasyonlarından ölmektedir.
Kandaki düşük ürat konsantrasyonları, artan PD riski ile ilişkilidir.
İlaç kaynaklı parkinsonizm
Parkinsonizm vakalarında farklı tıbbi ilaçlar suçlanmıştır. İlaca bağlı parkinsonizm, normal olarak, kusurlu ajanın durdurulmasıyla tersine çevrilebilir. İlaçlar şunları içerir:
- Fenotiyazinler (klorpromazin, promazin vb.)
- Butirofenonlar (haloperidol, benperidol, vb.)
- metoklopramid
- tetrabenazin
1-Metil-4-fenil-1,2,3,6-tetrahidropiridin (MPTP), hayvan modeli araştırmalarında yaygın olarak kullanılan, geri dönüşü olmayan parkinsonizme neden olduğu bilinen bir ilaçtır.
Toksin kaynaklı parkinsonizm
Manganez ve karbon disülfür gibi bazı toksinler parkinsonizme neden olabilir .
Genetik
Araştırmalar, PD'nin genetik ve çevresel faktörlerin karmaşık bir etkileşiminin ürünü olduğunu göstermektedir . PD'li bireylerin yaklaşık %15'inin birinci derece akrabalarında hastalığı vardır ve PD'li kişilerin %5-10'unun birkaç spesifik genden birindeki mutasyon nedeniyle ortaya çıkan hastalık biçimlerine sahip olduğu bilinmektedir . Bu gen mutasyonlarından birini barındırmak hastalığa yol açmayabilir; duyarlılık faktörleri, genellikle başlangıç yaşı, şiddeti ve ilerlemeyi de etkileyen diğer risk faktörleriyle birlikte bireyi artan bir riske sokar. PD gelişiminde en az 11 otozomal dominant ve 9 otozomal resesif gen mutasyonu yer almıştır. Otozomal dominant genler arasında SNCA , PARK3 , UCHL1 , LRRK2 , GIGYF2 , HTRA2 , EIF4G1 , TMEM230, CHCHD2 , RIC3 , ve VPS35 . Otozomal çekinik genler arasında PRKN , PINK1 , PARK7 , ATP13A2 , PLA2G6 , FBXO7 , DNAJC6 , SYNJ1 ve VPS13C bulunur . Bazı genler X'e bağlıdır veya bilinmeyen kalıtım modeline sahiptir; bunlara PARK10, PARK12 ve PARK16 dahildir . Bir 22q11 delesyon aynı zamanda PD ile ilişkili olduğu bilinmektedir. Bir otozomal dominant formu mutasyonlara bağlı olan LRP10 geni.
PD'li kişilerin yaklaşık % 5'inde GBA1 geninde mutasyonlar vardır . Bu mutasyonlar, etkilenmemiş popülasyonun %1'inden daha azında bulunur. Bu mutasyonlar varsa PD geliştirme riski 20-30 kat artar. Bu mutasyonlarla ilişkili PD aynı klinik özelliklere sahiptir, ancak daha erken bir başlangıç yaşı ve daha hızlı bilişsel ve motor düşüş. Bu gen, glukoserebrosidazı kodlar . Bu enzimin düşük seviyeleri Gaucher hastalığına neden olur .
SNCA gen mutasyonları PD'de önemlidir çünkü bu genin kodladığı protein, alfa-sinüklein , PD'li kişilerin beyinlerinde biriken Lewy cisimciklerinin ana bileşenidir . Alfa-sinüklein , büyük bir DNA hasarı- onarım sinyal kinazı olan mutasyona uğramış ataksi telenjiektaziyi aktive eder . Ek olarak, alfa-sinüklein, homolog olmayan uç birleştirme DNA onarım yolunu aktive eder . Lewy cisimciklerinde alfa-sinükleinin toplanması, PD'de azalmış DNA onarımı ile beyin hücresi ölümü arasında bir bağlantı gibi görünmektedir .
SNCA , LRRK2 ve GBA dahil olmak üzere bazı genlerdeki mutasyonların "sporadik" (ailesel olmayan) PD için risk faktörleri olduğu bulunmuştur. LRRK2 genindeki mutasyonlar , ailesel ve sporadik PD'nin bilinen en yaygın nedeni olup, ailede hastalık öyküsü olan bireylerin yaklaşık %5'ini ve sporadik vakaların %3'ünü oluşturur. GBA'daki bir mutasyon, Parkinson hastalığının gelişmesinde en büyük genetik riski sunar.
Parkinson ile ilgili birkaç gen, hücresel atık ürünleri sindiren organeller olan lizozomların işlevinde yer alır . Bazı PD vakalarına, hücrelerin alfa-sinükleini parçalama yeteneğini azaltan lizozomal bozukluklar neden olabilir .
Vasküler parkinsonizm
Vasküler parkinsonizm, Parkinson hastalığı semptomlarının vasküler olayların bulgularıyla ( beyin felci gibi ) birlikte bulunması olgusudur . Dopaminerjik yolakların zarar görmesi, hem vasküler parkinsonizm hem de idiyopatik PD için neden olarak benzerdir, bu nedenle aynı semptomların çoğuyla ortaya çıkabilirler. Dikkatli yatak başı muayenesi, öykü değerlendirmesi ve görüntüleme ile ayırt edilebilir.
Parkinsonizmin diğer tanımlanabilir nedenleri arasında enfeksiyonlar ve metabolik düzensizlik bulunur. Birkaç nörodejeneratif bozukluk da parkinsonizm ile ortaya çıkabilir ve bazen "atipik parkinsonizm" veya "Parkinson artı" sendromları olarak adlandırılır (parkinsonizmli hastalıklar ve bunları PD'den ayıran diğer bazı özellikler). Bunlar arasında çoklu sistem atrofisi , ilerleyici supranükleer felç , kortikobazal dejenerasyon ve Lewy cisimcikli demans bulunur. Lewy cisimcikli demans başka bir sinükleinopatidir ve özellikle Parkinson hastalığı demansı olarak bilinen demanslı PD vakalarının alt grubu ile PD ile yakın patolojik benzerliklere sahiptir . PD ve DLB arasındaki ilişki karmaşıktır ve tam olarak anlaşılmamıştır. Değişken ayırt edici klinik ve patolojik özelliklere sahip bir sürekliliğin parçalarını temsil edebilirler veya ayrı hastalıklar olduklarını kanıtlayabilirler.
patofizyoloji

PD'nin ana patolojik özellikleri, beynin bazal ganglionlarındaki hücre ölümüdür (yaşamın sonuna kadar substantia nigra pars compacta'daki dopamin salgılayan nöronların %70'ini etkiler ). Parkinson hastalığında, alfa-sinüklein yanlış katlanır ve diğer alfa-sinüklein ile birlikte kümelenir . Hücreler bu kümeleri çıkaramaz ve alfa sinüklein hücrelere zarar vererek sitotoksik hale gelir . Bu kümeler, mikroskop altında nöronlarda görülebilir ve Lewy cisimcikleri olarak adlandırılır. Nöronların kaybına astrositlerin ölümü (yıldız şeklindeki glial hücreler) ve substantia nigra'daki mikroglia sayısında (başka bir glial hücre türü ) önemli bir artış eşlik eder . Braak evrelemesi , PD'den etkilenen beyin bölümlerinin ilerlemesini açıklamanın bir yoludur. Bu evrelemeye göre, PD, substantia nigra pars compacta'ya ve orta beyin/bazal ön beynin geri kalanına geçmeden önce medulla ve koku soğancığında başlar. Hareket semptomu başlangıcı, hastalık esas olarak nigra pars compacta'yı etkilemeye başladığında ilişkilidir.
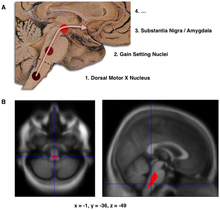
- Braak ve meslektaşları tarafından önerildiği gibi, PD'nin ilk aşamalarında Lewy cisim birikintilerinin şematik ilk ilerlemesi
- Beyin sapı hasarının PD nöropatolojisinin ilk tanımlanabilir aşaması olabileceği sonucuna varan bir nörogörüntüleme çalışmasında, hastalığı olmayan bir grup katılımcıyla karşılaştırıldığında, ilk PD'de önemli beyin hacmi azalması alanının lokalizasyonu
Beyindeki beş ana yol, diğer beyin alanlarını bazal gangliyonlara bağlar. Bunlar motor , okülomotor , ilişkisel , limbik ve orbitofrontal devreler olarak bilinir ve adları her devrenin ana projeksiyon alanını gösterir. Hepsi PD'den etkilenir ve bu devreler hareket, dikkat ve öğrenme dahil olmak üzere çok çeşitli işlevlerde yer aldığından, bunların bozulması hastalığın birçok semptomunu açıklar. Bilimsel olarak en yoğun olarak motor devresi incelenmiştir.
Motor devresinin belirli bir kavramsal modeli ve PD ile değiştirilmesi, 1980'den beri büyük bir etkiye sahip olmuştur, ancak değişikliklere yol açan bazı sınırlamalara işaret edilmiştir. Bu modelde, bazal gangliyonlar normal olarak geniş bir motor sistemleri yelpazesi üzerinde sabit bir engelleyici etki uygulayarak, onların uygun olmayan zamanlarda aktif hale gelmelerini engeller. Belirli bir eylemi gerçekleştirmeye karar verildiğinde , gerekli motor sistemi için inhibisyon azaltılır ve böylece aktivasyon için serbest bırakılır. Dopamin, bu inhibisyon salınımını kolaylaştırmak için hareket eder, bu nedenle yüksek dopamin fonksiyonu seviyeleri motor aktiviteyi teşvik etme eğilimindeyken, PD'de olduğu gibi düşük dopamin fonksiyonu seviyeleri, herhangi bir hareket için daha fazla çaba sarf edilmesini gerektirir. Bu nedenle, dopamin tükenmesinin net etkisi, motor çıkışında genel bir azalma olan hipokinezi üretmektir . PD'yi tedavi etmek için kullanılan ilaçlar ise tersine aşırı dopamin aktivitesi üreterek motor sistemlerin uygun olmayan zamanlarda etkinleştirilmesine ve dolayısıyla diskinezilere neden olabilir .
beyin hücresi ölümü
Spekülasyon, beyin hücrelerinin kaybolabileceği çeşitli mekanizmalara işaret ediyor. Bir mekanizma , hasarlı hücrelerde ubikuitine bağlı protein alfa-sinükleinin anormal birikiminden oluşur . Bu çözünmeyen protein nöronların içinde birikir ve Lewy cisimcikleri adı verilen inklüzyonlar oluşturur . Heiko Braak tarafından önerilen patolojik bulgulara dayalı bir hastalık sınıflandırması olan Braak evrelemesine göre , Lewy cisimcikleri ilk önce olfaktör bulbus , medulla oblongata ve pontin tegmentumda görülür ; Bu aşamadaki bireyler asemptomatik olabilir veya erken motor olmayan semptomlara sahip olabilir (koku alma duyusu kaybı veya bir miktar uyku veya otomatik işlev bozukluğu gibi). Hastalık ilerledikçe, substantia nigra, orta beyin ve bazal ön beyin alanları ve son olarak neokortekste Lewy cisimcikleri gelişir . Bu beyin bölgeleri, PD'de nöronal dejenerasyonun ana yerleridir, ancak Lewy cisimcikleri hücre ölümüne neden olmayabilir ve koruyucu olabilirler (anormal protein sekestre edilmiş veya duvarlanmış). Lewy cisimciklerinde ve Lewy nöritlerinde toplanmayan diğer alfa-sinüklein formları (örneğin, oligomerler ) aslında proteinin toksik formları olabilir. Demansı olan kişilerde, kortikal alanlarda genel bir Lewy cisimcikleri varlığı yaygındır. Alzheimer hastalığının özelliği olan nörofibriler yumaklar ve yaşlılık plakları , kişi demans olmadıkça yaygın değildir.
Diğer hücre ölümü mekanizmaları, proteazomal ve lizozomal sistem işlev bozukluğunu ve azalmış mitokondriyal aktiviteyi içerir. Substantia nigra'da demir birikimi tipik olarak protein kapanımları ile birlikte gözlenir. Oksidatif stres , protein agregasyonu ve nöron ölümü ile ilişkili olabilir , ancak mekanizmalar tam olarak anlaşılmamıştır.
Teşhis
Bir doktor başlangıçta dikkatli bir tıbbi öykü ve nörolojik muayene ile PD'yi değerlendirir . Motor semptomları (bradikinezi, istirahat tremoru, vb.) doğrulamaya ve aşağıda tartışılan klinik tanı kriterleri ile destekleyici testlere odaklanılır. Otopsi sırasında orta beyinde Lewy cisimciklerinin bulunması , genellikle kişinin Parkinson hastası olduğunun nihai kanıtı olarak kabul edilir. Hastalığın zamanla klinik seyri, PD olmadığını ortaya çıkarabilir ve teşhisin doğruluğunu doğrulamak için klinik sunumun periyodik olarak gözden geçirilmesini gerektirebilir.
Parkinsonizm veya benzer görünen hastalıklar için birden fazla neden ortaya çıkabilir. İnme , bazı ilaçlar ve toksinler "ikincil parkinsonizme" neden olabilir ve ziyaret sırasında değerlendirilmesi gerekir. Progresif supranükleer felç ve çoklu sistem atrofisi gibi Parkinson-plus sendromları da farklı tedavi ve hastalık ilerlemesi nedeniyle uygun şekilde göz önünde bulundurulmalı ve ekarte edilmelidir (anti-Parkinson ilaçları Parkinson-plus sendromlarında semptomları kontrol etmede tipik olarak daha az etkilidir). Daha hızlı ilerleme oranları, erken bilişsel işlev bozukluğu veya postural instabilite, minimal titreme veya başlangıçtaki simetri, PD'nin kendisinden ziyade Parkinson artı hastalığını gösterebilir.
Tıp kuruluşları , özellikle hastalığın erken evrelerinde tanı sürecini kolaylaştırmak ve standardize etmek için tanı kriterleri oluşturmuştur. En yaygın olarak bilinen kriterler, Birleşik Krallık Queen Square Beyin Nörolojik Bozukluklar Bankası ve ABD Ulusal Nörolojik Bozukluklar ve İnme Enstitüsü'nden gelmektedir . Queen Square Brain Bank kriterleri, hareket yavaşlığı (bradikinezi) artı rijidite, istirahat tremoru veya postural instabilite gerektirir. Bu semptomların diğer olası nedenleri ekarte edilmelidir. Son olarak, başlangıç veya evrim sırasında aşağıdaki destekleyici özelliklerden üç veya daha fazlası gereklidir: tek taraflı başlangıç, istirahatte titreme, zaman içinde ilerleme, motor semptomların asimetrisi, en az beş yıl boyunca levodopaya yanıt, en az on yıllık klinik seyir ve aşırı levodopa alımının neden olduğu diskinezilerin görünümü .
PH tanıları otopsi ile kontrol edildiğinde, hareket bozuklukları uzmanları ilk değerlendirmede ortalama %79,6 ve takip muayenelerinde tanılarını düzelttikten sonra %83,9 doğru bulunmuştur. Çoğunlukla uzman olmayanlar tarafından konulan klinik tanılar otopsi ile kontrol edildiğinde ortalama doğruluk %73,8'dir. Genel olarak, PH tanılarının %80,6'sı doğru ve Beyin Bankası kriterlerini kullanan tanıların %82.7'si doğrudur.
Uluslararası Parkinson ve Hareket Bozukluğu Derneği'nin bir görev gücü, Parkinson hastalığı için tanı kriterleri ve ayrıca prodromal hastalık teşhisi için araştırma kriterleri önermiştir , ancak bunlar daha yerleşik kriterlere göre doğrulama gerektirir.
görüntüleme
PD'li kişilerin bilgisayarlı tomografi (BT) taramaları genellikle normal görünür. Manyetik rezonans görüntüleme, özellikle demire duyarlı T2* ve en az 3T manyetik alan gücünde duyarlılık ağırlıklı görüntüleme dizileri aracılığıyla hastalığın teşhisinde zamanla daha doğru hale geldi ve her ikisi de karakteristik "kırlangıç kuyruğu"nun olmadığını gösterebilir. dorsolateral substantia nigra'da görüntüleme paterni . Bir meta-analizde, bu kalıbın yokluğu , hastalığa oldukça duyarlı ve spesifikti . Bir 2020 meta-analizi, nöromelanin-MRI'nin Parkinson hastalarını sağlıklı deneklerden ayırt etmede olumlu bir teşhis performansına sahip olduğunu buldu . Difüzyon MRG , teşhis değeri hala araştırılmakta olmasına rağmen, PD ve Parkinson-plus sendromları arasında ayrım yapma potansiyeli göstermiştir. BT ve MRG ayrıca, parkinsonizmin ikincil nedenleri olabilen diğer hastalıkları, en yaygın olarak ensefalit ve kronik iskemik hakaretleri ve ayrıca bazal ganglion tümörleri ve hidrosefali gibi daha az sık görülen hastalıkları dışlamak için kullanılır .
Metabolik aktivite, bir dopamin taşıyıcı bazal gangliyada ile doğrudan ölçülebilir pozitron emisyon tomografisi ve bilgisayarlı tomografi tek foton emisyonu ile tarar DaTSCAN Bu çalışmada ortak bir özel versiyonu olan. PD'nin klinik tanıları ile yüksek uyum göstermiştir. Bazal gangliyonlarda azaltılmış dopamine bağlı aktivite, ilaca bağlı Parkinsonizmi dışlamaya yardımcı olabilir. Ancak bu bulgu tamamen spesifik değildir ve hem PD hem de Parkinson artı bozukluklarda görülebilir. Amerika Birleşik Devletleri'nde DaTSCAN'lar, PD veya Parkinson sendromlarını esansiyel tremordan ayırt etmek için yalnızca FDA tarafından onaylanmıştır .
İyot-123-meta-iyodobenzilguanidin miyokard sintigrafisi , kalp çevresindeki kasların denervasyonunu bulmaya yardımcı olabilir ve bu da PD tanısını destekleyebilir.
Ayırıcı tanı
İkincil parkinsonizm - Parkinsonizmin çoklu nedenleri dikkatli öykü, fizik muayene ve uygun görüntüleme ile ayırt edilebilir. Bu konu ayrıca nedenleri bölümünde tartışılmaktadır burada .
Parkinson artı sendromu - Kortikobazal sendrom , çoklu sistem atrofisi , ilerleyici supranükleer felç ve lewy cisimcikli demans dahil olmak üzere birden fazla hastalık Parkinson artı grubunun bir parçası olarak kabul edilebilir . Ayırıcı tanı, dikkatli bir öykü ve fiziksel (özellikle spesifik semptomların başlangıcına odaklanmış), hastalığın ilerlemesi ve tedaviye yanıt ile daraltılabilir. Aralarındaki bazı önemli özellikler:
- Kortikobazal sendrom - levodopa direnci, miyoklonus , distoni , kortikosensör kaybı, apraksi ve akıcı olmayan afazi
- Çoklu sistem atrofisi - levodopa direnci, hızlı ilerleyen, otonomik yetmezlik, stridor, mevcut Babinski işareti , serebellar ataksi ve spesifik MRG bulguları
- Progresif supranükleer felç - levodopa direnci, kısıtlayıcı dikey bakış, spesifik MRG bulguları ve erken ve farklı postüral zorluklar
- Lewy cisimcikli demans - levodopa direnci, motor semptomlardan önce bilişsel baskınlık ve değişken bilişsel semptomlar (görsel halüsinasyonlar bu hastalıkta çok yaygındır, ancak PD hastalarında da vardır)
- Esansiyel tremor - Bu ilk başta parkinsonizm gibi görünebilir, ancak önemli farklılaştırıcıları vardır. Esansiyel tremorda, tremor eylemle daha da kötüleşir (oysa PD'de iyileşir), PD'de diğer semptomların eksikliği yaygındır ve normal DatSCAN görülür.
PD'ye benzer sunumlara sahip olabilecek diğer koşullar şunları içerir:
- Artrit
- Creutzfeldt-Jakob hastalığı
- distoni
- Depresyon
- Frajil X ile ilişkili tremor/ataksi sendromu
- Kromozom 17 ile bağlantılı frontotemporal demans ve parkinsonizm
- Huntington hastalığı
- İdiyopatik bazal ganglion kalsifikasyonu
- Beyin demir birikimi ile nörodejenerasyon
- Normal basınçlı hidrosefali
- takıntılı yavaşlık
- psikojenik parkinsonizm
- Wilson hastalığı
Önleme
Orta yaşta egzersiz, yaşamın ilerleyen dönemlerinde PD riskini azaltabilir. Kafein ayrıca, kahve gibi kafeinli içeceklerin daha fazla alınmasıyla ortaya çıkan riskte daha büyük bir azalma ile koruyucu görünmektedir.
C ve E vitaminleri gibi antioksidanların hastalığa karşı koruma sağladığı öne sürülmüştür, ancak çalışmaların sonuçları çelişkilidir ve olumlu bir etkisi kanıtlanmamıştır. Yağ ve yağ asitleri ile ilgili sonuçlar , koruyucu, risk artırıcı veya hiçbir etki bildirmeyen çeşitli çalışmalarla çelişkilidir. Antiinflamatuar ilaçların ve kalsiyum kanal blokerlerinin kullanımının koruyucu olabileceğine dair ön göstergeler olmuştur . Bir 2010 meta-analizi , nonsteroid antiinflamatuar ilaçların ( aspirin dışında ), PD gelişme insidansında en az %15'lik (uzun süreli ve düzenli kullanıcılarda daha yüksek) bir azalma ile ilişkili olduğunu bulmuştur .
Yönetmek
Parkinson hastalığının tedavisi bilinmemektedir. İlaçlar, cerrahi ve fizik tedavi rahatlama sağlayabilir, bir kişinin yaşam kalitesini iyileştirebilir ve Alzheimer hastalığı, motor nöron hastalığı ve Parkinson artı sendromları gibi diğer nörolojik bozukluklar için mevcut tedavilerden çok daha etkilidir . Motor semptomları tedavi etmek için yararlı olan ana ilaç aileleri, her zaman bir dopa dekarboksilaz inhibitörü ve bazen de bir COMT inhibitörü , dopamin agonistleri ve MAO-B inhibitörleri ile birleştirilen levodopadır . Hastalığın evresi ve hastalığın başlangıç yaşı hangi grubun en yararlı olduğunu belirler.
PD'nin Braak evrelemesi , erken, orta ve geç evreleri tanımlayabilen altı evre kullanır. Bazı engellilik halinin geliştiği ve farmakolojik tedavi gerektirdiği ilk aşamayı, levodopa kullanımına bağlı komplikasyonların gelişmesiyle ilişkili sonraki aşamalar ve dopamin eksikliği veya levodopa tedavisiyle ilgili olmayan semptomların baskın olabileceği üçüncü aşama izler.
İlk aşamadaki tedavi, semptom kontrolü ve tedavi yan etkileri arasında optimal bir denge sağlamayı amaçlar . Levodopa kullanımına bağlı komplikasyonların başlamasını geciktirme umuduyla, başlangıçta MAO-B inhibitörleri ve dopamin agonistleri gibi başka ilaçlar kullanılarak levodopa tedavisinin başlangıcı ertelenebilir. Levodopa, PD'nin motor semptomları için hala en etkili tedavidir ve yaşam kaliteleri bozulduğunda insanlarda ertelenmemelidir. Levodopa ile ilişkili diskineziler, levodopa tedavisinin süresinden çok hastalığın süresi ve ciddiyeti ile daha güçlü bir şekilde ilişkilidir, bu nedenle bu tedaviyi geciktirmek, erken kullanımdan çok daha uzun diskinezisiz süre sağlamayabilir.
Daha sonraki aşamalarda amaç, ilacın etkisindeki dalgalanmaları kontrol ederken PD semptomlarını azaltmaktır. İlaçtan ani çekilmeler veya aşırı kullanımı yönetilmelidir. Oral ilaçlar semptomları kontrol etmek için yeterli olmadığında, cerrahi, derin beyin stimülasyonu , subkutan uyanık gün apomorfin infüzyonu ve enteral dopa pompaları faydalı olabilir. Geç evre PD, başta depresyon, ortostatik hipotansiyon, mesane disfonksiyonu ve erektil disfonksiyon olmak üzere psikiyatrik semptomlar için olanlar dahil olmak üzere çeşitli tedaviler gerektiren birçok zorluk sunar . Hastalığın son evrelerinde kişinin yaşam kalitesini yükseltmek için palyatif bakım sağlanır.
bilişsel eğitim
Bir 2020 Cochrane incelemesi, Parkinson hastalığı, bunama veya hafif bilişsel bozukluğu olan kişiler için bilişsel eğitimin faydalı olduğuna dair kesin bir kanıt bulamadı. Bulgular, yedi çalışmanın düşük kesinlik kanıtlarına dayanmaktadır.
İlaçlar
levodopa
PD'nin motor semptomları, beynin bazal ganglionlarında dopamin üretiminin azalmasının sonucudur. Dopamin kan-beyin bariyerini geçmez , bu nedenle beynin tükenmiş dopamin seviyelerini artırmak için bir ilaç olarak alınamaz, ancak bir dopamin öncüsü olan levodopa, beyne geçebilir ve burada kolayca dopamine dönüştürülür, ve levodopa uygulaması PD'nin motor semptomlarını geçici olarak azaltır. Levodopa, 40 yılı aşkın süredir en yaygın kullanılan PD tedavisi olmuştur.
Levodopanın sadece %5-10'u kan-beyin bariyerini geçer. Geri kalanın çoğu vücudun başka yerlerinde dopamine metabolize olur ve mide bulantısı , kusma ve ortostatik hipotansiyon gibi çeşitli yan etkilere neden olur . Karbidopa ve benserazid olan dopa dekarboksilaz inhibitörleri , kan-beyin bariyerini geçer ve yan etkilerinin azaltılmasına ve beyin içine geçişi için levodopa yer iyileştirilmesi, beyin dışında dopamine levodopa dönüşümünü engellemezler. Bu ilaçlardan biri genellikle levodopa ile birlikte alınır, genellikle aynı hap içinde levodopa ile birleştirilir.
Levodopa kullanımı uzun vadede istemsiz hareketler (diskineziler) ve ilacın etkinliğinde dalgalanmalar gibi komplikasyonların gelişmesine yol açar. Dalgalanmalar meydana geldiğinde, bir kişi ilaca iyi yanıt veren ve PD semptomlarının azaldığı ("açık" durum) ve ilaca zayıf yanıt veren ve önemli PD semptomları olan ("kapalı" durum) fazlar arasında geçiş yapabilir. Daha düşük dozlarda levodopa kullanılması, levodopanın neden olduğu bu komplikasyonların riskini ve şiddetini azaltabilir. Levodopa ile ilişkili diskinezi ve dalgalanmaları azaltmak için eski bir strateji, levodopa ilacını bir süreliğine kesmekti. Nöroleptik malign sendrom gibi tehlikeli yan etkilere yol açabileceğinden bu artık önerilmemektedir . PD'li çoğu insan sonunda levodopaya ihtiyaç duyar ve daha sonra levodopa kaynaklı dalgalanmalar ve diskineziler geliştirir.
Levodopanın kontrollü salımlı (CR) versiyonları mevcuttur. Daha eski CR levodopa müstahzarları zayıf ve güvenilmez absorpsiyona ve biyoyararlanımlara sahiptir ve hızlı salımlı müstahzarlarla karşılaştırıldığında PD motor semptomlarının kontrolünü iyileştirdiğini veya levodopa ile ilgili komplikasyonlarda bir azalma göstermemiştir. Daha yeni bir uzatılmış salımlı levodopa preparatı, dalgalanmaları azaltmada daha etkili görünüyor, ancak birçok insanda sorunlar devam ediyor. İntestinal levodopa (Duodopa) infüzyonları, dalgalanmaların gastroparezinin neden olduğu yetersiz alımdan kaynaklandığı durumlarda, oral levodopaya kıyasla dalgalanmalarda çarpıcı gelişmelere neden olabilir . Diğer oral, daha uzun etkili formülasyonlar üzerinde çalışılmakta ve diğer uygulama şekilleri (inhale, transdermal) geliştirilmektedir.
COMT inhibitörleri
PD sırasında, etkilenen insanlar, bir levodopa dozundan sonra, ancak bir sonraki dozdan hemen önce semptomların tekrarladığı, "aşınma fenomeni" olarak bilinen şeyi deneyimleyebilirler. Katekol-O-metiltransferaz (COMT), levodopayı kan-beyin bariyerini geçmeden önce parçalayan bir proteindir ve bu inhibitörler daha fazla levodopanın geçmesine izin verir. Normalde erken semptomların tedavisinde kullanılmazlar, ancak bir kişi motor semptomları ile "aşınma fenomeni" yaşadığında levodopa/karbidopa ile birlikte kullanılabilirler.
PD ve doz sonu motor dalgalanmaları olan yetişkinleri tedavi etmek için üç COMT inhibitörü mevcuttur - opikapon , entakapon ve tolkapon . Tolcapone birkaç yıldan beri mevcuttur, ancak olası karaciğer hasarı komplikasyonları nedeniyle yararlılığı sınırlıdır, bu nedenle karaciğer fonksiyonunun izlenmesini gerektirir. Entakapon ve opikaponun karaciğer fonksiyonunda önemli değişikliklere neden olduğu gösterilmemiştir. Entakaponun ruhsatlı müstahzarları, tek başına veya karbidopa ve levodopa ile kombinasyon halinde entakapon içerir. Opicapone, günde bir kez uygulanan bir COMT inhibitörüdür.
dopamin agonistleri
Beyindeki dopamin reseptörlerine bağlanan birkaç dopamin agonisti , levodopa ile benzer etkilere sahiptir. Bunlar başlangıçta levodopa komplikasyonları (açma-kapama dalgalanmaları ve diskineziler) yaşayan bireyler için levodopaya tamamlayıcı bir tedavi olarak kullanıldı; levodopa tedavisinin başlamasını geciktirmek ve böylece levodopa komplikasyonlarının başlamasını geciktirmek amacıyla PD'nin motor semptomları için artık esas olarak kendi başlarına ilk tedavi olarak kullanılmaktadırlar. Dopamin agonistleri arasında bromokriptin , pergolid , pramipeksol , ropinirol , piribedil , kabergolin , apomorfin ve lisurid bulunur .
Dopamin agonistleri, PD motor semptomlarını kontrol etmede levodopadan daha az etkili olsalar da, genellikle tedavinin ilk yıllarında bu semptomları yönetmeye yetecek kadar etkilidirler. Dopamin agonistlerine bağlı diskineziler, Parkinson hastalığı olan genç insanlarda nadirdir, ancak diğer komplikasyonlarla birlikte, başlangıç yaşı ilerledikçe daha yaygın hale gelir. Bu nedenle, genç başlangıçlı PD için tercih edilen başlangıç tedavisi dopamin agonistleridir ve daha yaşlı başlangıçlı PD için levodopa tercih edilir.
Dopamin agonistleri, genellikle hafif olmakla birlikte, uyuşukluk, halüsinasyonlar, uykusuzluk, mide bulantısı ve kabızlık gibi yan etkiler üretir. Bazen klinik olarak etkili minimum dozlarda bile yan etkiler ortaya çıkar ve bu da hekimi farklı bir ilaç aramaya sevk eder. Agonistler dürtü kontrol bozukluklarıyla (zorlayıcı cinsel aktivite, yemek yeme, kumar ve alışveriş gibi) levodopadan bile daha güçlü bir şekilde ilişkilendirilmiştir. Levodopadan daha pahalı olma eğilimindedirler.
Bir dopamin agonisti olan apomorfin , geç PD'de kapalı dönemleri ve diskineziyi azaltmak için kullanılabilir. Sadece aralıklı enjeksiyonlar veya sürekli deri altı infüzyonları ile uygulanır . Konfüzyon ve halüsinasyonlar gibi ikincil etkiler yaygın olduğundan, apomorfin tedavisi alan kişiler yakından izlenmelidir. Deri yamaları ( lisurid ve rotigotin ) yoluyla uygulanan iki dopamin agonisti , ilk aşamalardaki insanlar için ve muhtemelen ileri durumlardaki durumları kontrol altına almak için faydalıdır.
MAO-B inhibitörleri
MAO-B inhibitörleri ( safinamid , selegilin ve rasagilin ), dopamini parçalayan bir enzim olan monoamin oksidaz B'nin aktivitesini inhibe ederek bazal ganglionlardaki dopamin miktarını arttırır. Monoterapi olarak (kendi başlarına) kullanıldıklarında motor semptomları hafifletmeye yardımcı oldukları bulunmuştur; levodopa ile birlikte kullanıldıklarında, "kapalı" aşamada harcanan süreyi azaltırlar. Selegilin'in levodopa başlama ihtiyacını geciktirdiği, bunun nöroprotektif olabileceğini ve hastalığın ilerlemesini yavaşlatabileceğini düşündürdüğü gösterilmiştir (ancak bu kanıtlanmamıştır). İlk bir çalışma, selegilinin levodopa ile kombinasyonunun ölüm riskini artırdığını gösterdi, ancak bu reddedildi.
Yaygın yan etkiler mide bulantısı, baş dönmesi, uykusuzluk, uyku hali ve (selejilin ve rasagilin'de) ortostatik hipotansiyondur. Dopamin ile birlikte MAO-B'lerin serotonini artırdığı bilinmektedir, bu nedenle serotonin sendromu olarak bilinen potansiyel olarak tehlikeli bir durum nedeniyle belirli antidepresanlarla birlikte kullanıldığında dikkatli olunmalıdır .
Diğer uyuşturucular
Amantadin ve antikolinerjikler gibi diğer ilaçlar , motor semptomların tedavisi olarak faydalı olabilir, ancak bunları destekleyen kanıtların kalitesi yoktur, bu nedenle ilk tercih tedaviler değildirler. Motor semptomlara ek olarak, Parkinson hastalığına çeşitli semptomlar eşlik eder. Bu sorunlardan bazılarını tedavi etmek için çeşitli ilaçlar kullanılmıştır. Örnekler, psikoz için ketiapin , demans için kolinesteraz inhibitörleri ve aşırı gündüz uyku hali için modafinil kullanımıdır . 2016 yılında pimavanserin , PD psikozunun tedavisi için onaylandı. Doksepin ve rasaglin, PD'de fiziksel yorgunluğu azaltabilir.
Ameliyat

Motor semptomları ameliyatla tedavi etmek bir zamanlar yaygın bir uygulamaydı, ancak levodopanın keşfinden bu yana ameliyatların sayısı azaldı. Son birkaç on yılda yapılan çalışmalar, cerrahi tekniklerde büyük gelişmelere yol açmıştır, bu nedenle, ilaç tedavisinin artık yeterli olmadığı ileri PD'li kişilerde cerrahi yeniden kullanılmaktadır. PD cerrahisi iki ana gruba ayrılabilir - lezyonel ve derin beyin stimülasyonu (DBS). DBS veya lezyonlar için hedef alanlar talamus , globus pallidus veya subtalamik çekirdeği içerir . DBS, beynin belirli bölümlerine elektriksel uyarılar gönderen nörostimülatör adı verilen tıbbi bir cihazın implantasyonunu içerir . DBS, motor dalgalanmaları ve tremoru ilaçla yeterince kontrol edilemeyen Parkinson hastalarına veya ilaca karşı toleransı olmayan kişilere, ciddi nöropsikiyatrik sorunları olmadığı sürece önerilir. Daha az yaygın olan diğer cerrahi tedaviler, spesifik subkortikal alanların aşırı aktivitesini baskılamak için kasıtlı lezyon oluşumunu içerir . Örneğin pallidotomi , diskineziyi kontrol etmek için globus pallidusun cerrahi olarak yok edilmesini içerir.
PD'de beynin dört bölgesi nöral uyarıcılarla tedavi edilmiştir. Bunlar globus pallidus interna, talamus, subtalamik çekirdek ve pedunculopontin çekirdeğidir . Globus pallidus interna'nın DBS'si motor fonksiyonunu iyileştirirken, talamik DBS'nin DBS'si titremeyi iyileştirir, ancak bradikinezi veya sertlik üzerinde çok az etkisi vardır. Subtalamik çekirdeğin DBS'si, bir depresyon öyküsü veya nörobilişsel bozukluk varsa genellikle önlenir. Subtalamik çekirdeğin DBS'si, ilaçta bir azalma ile ilişkilidir. Pedunkülopontin çekirdek DBS şu anda deneysel olarak kalmaktadır. Genel olarak, DBS motor skor değerlendirmelerinde %30-60 iyileşme ile ilişkilidir.
Rehabilitasyon
Parkinson hastalarında egzersiz programları önerilir. Bazı kanıtlar, çalışmaların az ve düşük kalitede olmasına rağmen, konuşma veya hareketlilik sorunlarının rehabilitasyonla düzelebileceğini göstermektedir. Fizik tedavi ile veya fizik tedavi olmadan düzenli fiziksel egzersiz , hareketliliği, esnekliği, gücü, yürüme hızını ve yaşam kalitesini korumak ve geliştirmek için faydalı olabilir. Bir fizyoterapist gözetiminde bir egzersiz programı uygulandığında, evde kendi kendini denetleyen bir egzersiz programına kıyasla motor semptomlarda, zihinsel ve duygusal işlevlerde, günlük yaşam aktivitelerinde ve yaşam kalitesinde daha fazla iyileşme meydana gelir. Klinik egzersizler, Parkinson hastalarının genel refahını hedefleyen etkili bir müdahale olabilir. Motor fonksiyonda iyileşme ve depresyon olabilir.
Sertlik yaşayan insanlar için esnekliği ve hareket aralığını iyileştirmede, hafif sallanma gibi genelleştirilmiş gevşeme tekniklerinin aşırı kas gerginliğini azalttığı bulunmuştur. Gevşemeyi teşvik eden diğer etkili teknikler, ekstremitelerin ve gövdenin yavaş rotasyonel hareketlerini, ritmik başlatmayı, diyafram nefesini ve meditasyon tekniklerini içerir. Yürüyüşe gelince ve hipokinezi, ayak sürüyerek hareket etme ve kol salınımında azalma gibi hastalıkla ilişkili zorlukları ele almak için fizyoterapistlerin fonksiyonel hareketliliği ve güvenliği artırmak için çeşitli stratejileri vardır. Rehabilitasyon programları sırasında yürüyüşle ilgili ilgi alanları, yürüyüş hızının, desteğin tabanının, adım uzunluğunun ve gövde ve kol sallanma hareketlerinin iyileştirilmesine odaklanır. Stratejiler, yardımcı ekipman kullanmayı (direkte yürüme ve koşu bandında yürüme), sözlü ipucu vermeyi (manuel, görsel ve işitsel), egzersizleri (yürüyüş ve PNF kalıpları) ve ortamları değiştirmeyi (yüzeyler, girdiler, açık ve kapalı) içerir. Güçlendirme egzersizleri, hafif ila orta dereceli PD ile birincil kas zayıflığı ve hareketsizliğe bağlı zayıflığı olan kişilerde güç ve motor işlevde iyileşmeler göstermiştir, ancak raporlar, güç ve ilaçların alındığı zaman arasında önemli bir etkileşim olduğunu göstermektedir. Bu nedenle, Parkinson hastaları, ilaçlardan 45 dakika ila bir saat sonra, en iyi oldukları zamanlarda egzersiz yapmalıdır. Ayrıca ileri PD'de öne fleksiyon postürü ve solunum fonksiyon bozuklukları nedeniyle derin diyafram nefes egzersizleri göğüs duvarı mobilitesini ve vital kapasiteyi iyileştirmede faydalıdır. Egzersiz kabızlığı iyileştirebilir. PD'de egzersizin fiziksel yorgunluğu azaltıp azaltmadığı belirsizliğini koruyor.
Güç antrenmanı egzersizinin, manuel macunla egzersiz yaptıktan sonra PD hastalarında el becerisini arttırdığı gösterilmiştir . Bu, PD hastaları için kavrama sırasında günlük yaşamı olumlu yönde etkiler.
PD ile ilişkili konuşma bozuklukları için en yaygın uygulanan tedavilerden biri Lee Silverman ses tedavisidir (LSVT). Konuşma terapisi ve özellikle LSVT konuşmayı iyileştirebilir. Ergoterapi (OT), hastalığı olan kişilerin mümkün olduğunca çok günlük yaşam aktivitelerine katılmalarına yardımcı olarak sağlığı ve yaşam kalitesini yükseltmeyi amaçlar . OT'nin etkinliği üzerine az sayıda çalışma yapılmıştır ve bunların kalitesi, terapi süresi boyunca motor becerileri ve yaşam kalitesini iyileştirebileceğine dair bazı göstergeler olsa da, düşüktür.
Palyatif bakım
Palyatif bakım , Parkinson dahil ciddi hastalıkları olan kişiler için özel tıbbi bakımdır. Bu uzmanlığın amacı, hastalıkların semptomlarından, ağrılarından ve stresinden kurtulma sağlayarak hem PD'li kişi hem de aile için yaşam kalitesini iyileştirmektir. Parkinson tedavi edilebilir bir hastalık olmadığından, tüm tedaviler düşüşü yavaşlatmaya ve yaşam kalitesini iyileştirmeye odaklanır ve bu nedenle doğaları palyatiftir.
Palyatif bakım, hastalığın seyrine daha sonra değil, daha erken dahil edilmelidir. Palyatif bakım uzmanları, fiziksel semptomlar, işlev ve iş kaybı gibi duygusal faktörler, depresyon, korku ve varoluşsal kaygılar konusunda yardımcı olabilir.
Hem etkilenen kişiye hem de aileye duygusal destek sunmanın yanı sıra, palyatif bakım, bakımın amaçlarını belirlemede önemli bir rol oynar. PD'li kişiler, beslenme tüpü , noninvaziv ventilatör veya trakeostomi istekleri, kardiyopulmoner resüsitasyon için veya bunlara karşı istekler ve ne zaman bakımevinin kullanılacağı gibi hastalık ilerledikçe vermek için birçok zor karar alabilirler . Palyatif bakım ekibi üyeleri, kendi değerlerine dayalı olarak en iyi kararı vermelerine yardımcı olmak için bu karmaşık ve duygusal konularda PD'li kişilere soruları yanıtlamaya ve rehberlik etmeye yardımcı olabilir.
Sindirim sürecini kontrol eden kaslar ve sinirler PD'den etkilenebilir, bu da kabızlık ve gastroparezi (midede normalden daha uzun süre kalan yiyecekler) ile sonuçlanır . Periyodik beslenme değerlendirmelerine dayanan dengeli bir diyet önerilir ve kilo kaybını veya alımını önlemek ve gastrointestinal fonksiyon bozukluğunun sonuçlarını en aza indirecek şekilde tasarlanmalıdır. Hastalık ilerledikçe yutma güçlüğü ( disfaji ) ortaya çıkabilir. Bu gibi durumlarda sıvı alımı için koyulaştırıcı maddeler kullanmak ve yemek yerken dik bir duruş yapmak faydalı olabilir; her iki önlem de boğulma riskini azaltır. Ağır vakalarda yiyecekleri doğrudan mideye vermek için gastrostomi mümkündür.
Levodopa ve proteinler, bağırsakta ve kan-beyin bariyerinde aynı taşıma sistemini kullanır, böylece erişim için rekabet eder. Bunları bir araya getirmek ilacın etkinliğinin azalmasına neden olur. Bu nedenle, levodopa verildiğinde aşırı protein tüketimi önerilmez ve dengeli bir Akdeniz diyeti önerilir. İleri aşamalarda, benzer nedenlerle ekmek veya makarna gibi düşük proteinli ürünlerin ilave alımı önerilir. Proteinlerle etkileşimi en aza indirmek için levodopa yemeklerden 30 dakika önce alınmalıdır. Aynı zamanda, PD rejimleri, kahvaltı ve öğle yemeği sırasında proteinleri kısıtlayarak akşamları protein alımına izin verir.
prognoz

|
veri yok
< 5
5–12.5
12,5–20
20–27.5
27.5–35
35–42,5 |
42,5–50
50–57,5
57,5–65
65–72,5
72,5–80
> 80 |
PD her zaman zamanla ilerler. Birleşik Parkinson hastalığı derecelendirme ölçeği (UPDRS) olarak bilinen bir şiddet derecelendirme yöntemi , klinik bir çalışma için en yaygın kullanılan ölçümdür. MDS-UPDRS olarak bilinen değiştirilmiş bir versiyon da bazen kullanılmaktadır. Hoehn ve Yahr ölçeği (başlangıçta 1967'de yayınlanmıştır) olarak bilinen daha eski bir ölçekleme yöntemi ve Modifiye Hoehn ve Yahr ölçeği olarak bilinen benzer bir ölçek de yaygın olarak kullanılmıştır. Hoehn ve Yahr ölçeği, ilerlemenin beş temel aşamasını tanımlar.
Motor semptomlar, tedavi edilmezse, hastalığın erken evrelerinde agresif bir şekilde ilerler ve daha sonra daha yavaş ilerler. Tedavi edilmeyen bireylerin ortalama sekiz yıl sonra bağımsız yürümeyi kaybetmeleri ve 10 yıl sonra da yatalak olmaları beklenir . Bununla birlikte, günümüzde tedavi edilmeyen insanlara rastlamak nadirdir. İlaç, motor semptomların prognozunu iyileştirirken, aynı zamanda levodopanın yıllar sonra istenmeyen etkileri nedeniyle yeni bir sakatlık kaynağıdır. Levodopa alan kişilerde, semptomların bakıcılardan yüksek bağımlılık aşamasına ilerleme süresi 15 yıldan fazla olabilir. Belirli bir birey için hastalığın hangi seyri izleyeceğini tahmin etmek zordur. Yaş, hastalığın ilerlemesinin en iyi göstergesidir. Tanı anında daha az bozukluğu olanlarda motor gerileme oranı daha fazlayken, semptomların başlangıcında 70 yaşın üzerinde olanlarda kognitif bozukluk daha sıktır.
Mevcut tedaviler motor semptomları iyileştirdiğinden, şu anda engellilik esas olarak hastalığın motor olmayan özellikleriyle ilgilidir. Bununla birlikte, hastalığın ilerlemesi ve sakatlık arasındaki ilişki doğrusal değildir. Engellilik başlangıçta motor semptomlarla ilgilidir. Hastalık ilerledikçe, yeti yitimi, yutma/konuşma güçlükleri ve yürüme/denge sorunları gibi ilaca yeterince yanıt vermeyen motor semptomlarla daha fazla ilişkilidir; ve ayrıca 5 yıllık levodopa kullanımından sonra bireylerin %50'sine varan oranda ortaya çıkan levodopa kaynaklı komplikasyonlara. Son olarak, on yıl sonra hastalığı olan çoğu insanda otonomik bozukluklar, uyku sorunları, duygudurum değişiklikleri ve bilişsel gerileme görülür. Tüm bu belirtiler, özellikle bilişsel gerileme, engelliliği büyük ölçüde artırır.
Yaşam beklentisi PD hastalarının azalır. Ölüm oranları , etkilenmeyen insanların yaklaşık iki katıdır. Bilişsel gerileme ve bunama, başlangıçtaki yaşlılık, daha ileri bir hastalık durumu ve yutma sorunlarının varlığı, tümü mortalite risk faktörleridir . Bununla birlikte, esas olarak sertlik yerine titreme ile karakterize edilen bir hastalık paterni, daha iyi bir sağkalımı öngörür. Aspirasyon pnömonisinden ölüm, PD'li bireylerde sağlıklı popülasyona göre iki kat daha yaygındır.
2016'da PD, 1990'dan bu yana %161'lik bir artışla dünya genelinde yaklaşık 211.000 ölümle sonuçlandı. Bu süre zarfında toplam ölüm oranı %19 artarak 100.000 kişi başına 1.81'e yükseldi.
epidemiyoloji
PD, Alzheimer hastalığından sonra ikinci en yaygın nörodejeneratif bozukluktur ve dünya çapında yaklaşık yedi milyon insanı ve Amerika Birleşik Devletleri'nde bir milyon insanı etkiler. Belirli bir zamanda bir popülasyonda oran sanayileşmiş ülkelerde% 0.3 hakkındadır. PD yaşlılarda daha sık görülür ve oranlar 60 yaşın üzerindekilerde %1'den 80 yaşın üzerindeki nüfusun %4'üne yükselir. Vakaların %5-10'u genç olarak sınıflandırılmasına rağmen, ortalama başlangıç yaşı 60 yaş civarındadır. başlangıçlı PD, 20 ila 50 yaşları arasında başlar. Erkekler yaklaşık 3:2 oranında kadınlardan daha sık etkilenir. PD, bu bulgu tartışmalı olsa da, Afrika ve Asya kökenlilerde daha az yaygın olabilir. Yıllık yeni vaka sayısı PD 100,000 başına 8 ila 18 kişi-yıldır.
Estonya'da yaşa göre düzeltilmiş Parkinson hastalığı oranı 28.0/100.000 kişi yılıdır. Estonya oranı 2000 ve 2019 yılları arasında sabit kalmıştır.
Tarih

Bir Mısır papirüsü , bir Ayurvedik tıbbi inceleme, İncil ve Galen'in yazıları dahil olmak üzere birçok erken kaynak, PD'ye benzeyen semptomları tanımlamaktadır. Galen'den sonra 17. yüzyıla kadar PD ile açık bir şekilde ilişkili hiçbir referans yoktur. 17. ve 18. yüzyıllarda, birkaç yazar, Sylvius , Gaubius , Hunter ve Chomel dahil olmak üzere hastalığın unsurları hakkında yazdı .
1817'de İngiliz doktor James Parkinson , altı felç ajitans vakasını bildiren makalesini yayınladı. Sarsıntı Felci Üzerine Bir Deneme , karakteristik istirahat titremesini, anormal duruş ve yürümeyi, felç ve azalan kas gücünü ve hastalığın zaman içinde nasıl ilerlediğini anlattı. Hastalığın bilgisine daha fazla ekleme yapan ilk nörologlar arasında Trousseau , Gowers , Kinnier Wilson ve Erb ve en önemlisi , 1868 ile 1881 arasındaki çalışmaları hastalığın anlaşılmasında bir dönüm noktası olan Jean-Martin Charcot yer alıyor. Diğer ilerlemelerin yanı sıra, sertlik, zayıflık ve bradikinezi arasındaki ayrımı yaptı. Ayrıca James Parkinson onuruna hastalığın yeniden adlandırılmasını savundu.
1912'de Frederic Lewy , daha sonra Lewy cisimcikleri olarak adlandırılan, etkilenen beyinlerdeki mikroskobik parçacıkları tanımladı. 1919'da Konstantin Tretiakoff , substantia nigra'nın etkilenen ana serebral yapı olduğunu bildirdi, ancak bu bulgu, 1938'de Rolf Hassler tarafından yayınlanan daha ileri çalışmalarla doğrulanıncaya kadar geniş çapta kabul görmedi . Beyindeki temel biyokimyasal değişiklikler 1950'lerde tanımlandı. , büyük ölçüde Arvid Carlsson'un nörotransmitter dopamin üzerindeki çalışmasına ve Oleh Hornykiewicz'in PD üzerindeki rolüne bağlı olarak. 1997'de, Spillantini , Trojanowski , Goedert ve diğerleri tarafından alfa-sinükleinin Lewy cisimciklerinin ana bileşeni olduğu bulundu .
Antikolinerjikler ve cerrahi ( kortikospinal yolun veya bazı bazal gangliyon yapılarının lezyonu ), levodopanın gelişine kadar, kullanımlarını önemli ölçüde azaltan tek tedavilerdi. Levodopa ilk olarak 1911'de Casimir Funk tarafından sentezlendi , ancak 20. yüzyılın ortalarına kadar çok az ilgi gördü. 1967'de klinik uygulamaya girdi ve PD yönetiminde bir devrim yarattı. 1980'lerin sonunda , Alim Louis Benabid ve Fransa'nın Grenoble kentindeki meslektaşları tarafından tanıtılan derin beyin stimülasyonu olası bir tedavi olarak ortaya çıktı.
Toplum ve kültür
Maliyet
PD'nin topluma maliyeti yüksektir, ancak araştırmalardaki metodolojik sorunlar ve ülkeler arasındaki farklılıklar nedeniyle kesin hesaplamalar zordur. Birleşik Krallık'taki yıllık maliyetin 49 milyon £ ile 3,3 milyar £ arasında olduğu tahmin edilirken, ABD'de etkilenen kişi başına yıllık maliyet muhtemelen yaklaşık 10.000 $ ve toplam yük yaklaşık 23 milyar $ civarındadır. Doğrudan maliyetin en büyük payı yatan hasta bakımı ve huzurevlerinden gelirken, ilaçlardan gelen pay önemli ölçüde daha düşüktür. Azalan üretkenlik ve bakıcılar üzerindeki yük nedeniyle dolaylı maliyetler yüksektir. PD, ekonomik maliyetlerine ek olarak, hastalığı olanların ve bakıcılarının yaşam kalitesini düşürür.
savunuculuk
James Parkinson'un doğum günü olan 11 Nisan, Dünya Parkinson Günü olarak belirlendi. 2005 yılında uluslararası kuruluşlar tarafından hastalığın sembolü olarak kırmızı lale seçilmiş; 1981 yılında Hollandalı bir bahçıvan tarafından tescil edilen 'James Parkinson' lale çeşidini temsil eder . Savunuculuk örgütleri arasında 1982'den beri 180 milyon dolardan fazla bakım, araştırma ve destek hizmetleri sağlayan Ulusal Parkinson Vakfı , kurulduğu günden bu yana araştırma için 115 milyon dolardan fazla ve eğitim ve savunuculuk programları için yaklaşık 50 milyon dolar dağıtan Parkinson Hastalığı Vakfı bulunmaktadır. 1957'de William Black tarafından kuruldu; Amerikan Parkinson Hastalığı Derneği 1961 yılında kurulmuş; ve 1992'de kurulan Avrupa Parkinson Hastalığı Derneği .
Önemli vakalar

Aktör Michael J. Fox'un PD'si var ve halkın hastalık hakkındaki farkındalığını büyük ölçüde artırdı. Teşhisten sonra Fox, Parkinson hastalığını televizyon rollerinde benimsedi, durumun etkilerini daha fazla göstermek için bazen ilaçsız hareket etti. Hastalıkla mücadelesinin önemli bir rol oynadığı iki otobiyografi yazdı ve hastalığın etkilerini göstermek için ilaçsız Amerika Birleşik Devletleri Kongresi'ne çıktı . Michael J. Fox Vakfı , Parkinson hastalığı için bir tedavi geliştirmeyi amaçlıyor. Fox , Parkinson hastalığına yaptığı katkılardan dolayı Karolinska Institutet'ten tıp alanında fahri doktora aldı .
40 yaşında genç başlangıçlı Parkinson teşhisi konan profesyonel bisikletçi ve olimpiyat madalyalı Davis Phinney , hastalığı olan kişilerin yaşam kalitesine odaklanan PD araştırmalarını desteklemek için 2004 yılında Davis Phinney Vakfı'nı kurdu.
Boksör Muhammed Ali 38 yaşında PD belirtileri gösterdi, ancak 42 yaşına kadar teşhis konmadı ve "dünyanın en ünlü Parkinson hastası" olarak adlandırıldı. Boksla ilgili PD veya parkinsonizm olup olmadığı çözülmedi.
2014 yılında intihar ettiği sırada , Amerikalı aktör ve komedyen Robin Williams'a PD teşhisi konmuştu. Dul eşine göre, otopsisinde yaygın Lewy vücut hastalığı bulunurken, otopsi yaygın Lewy vücut demansı terimini kullandı . Lewy Body Demans Derneği sözcüsü Dennis Dickson, yaygın Lewy vücut demansının daha yaygın olarak yaygın Lewy vücut hastalığı olarak adlandırıldığını ve altta yatan hastalık sürecini ifade ettiğini belirterek ayrımı netleştirdi . Lewy vücut demansları profesörü ve araştırmacısı Ian G. McKeith , Williams'ın semptomlarının ve otopsi bulgularının Lewy cisimcikli demans ile açıklandığını söyledi .
Araştırma
Parkinson için hiçbir hastalık değiştirici ilaç (nedenleri veya hasarı hedefleyen ilaçlar) onaylanmamıştır, bu nedenle bu, Parkinson araştırmasının ana odak noktasıdır. Aktif araştırma yönergeleri , hastalığın yeni hayvan modellerinin araştırılmasını ve gen tedavisinin , kök hücre transplantlarının ve nöroprotektif ajanların potansiyel faydasına ilişkin çalışmaları içerir .
Hayvan modelleri
Araştırmalarda hastalığın bazı özelliklerini gösteren hayvan modelleri kullanılsa da, PD'nin insan dışındaki hiçbir türde doğal olarak meydana geldiği bilinmemektedir. 1980'lerin başında, sentetik opiyat MPPP'nin kontamine bir partisini tüketen bir grup uyuşturucu bağımlısında parkinsonizmin ortaya çıkması, insan olmayan primatlarda ve insanlarda parkinsonizme neden olan bir ajan olarak kimyasal MPTP'nin keşfedilmesine yol açtı . Diğer baskın toksin bazlı modeller, insektisit rotenon , herbisit parakuat ve fungisit maneb'i kullanır . Toksinlere dayalı modeller en yaygın olarak primatlarda kullanılır . PD'nin çeşitli yönlerini kopyalayan transgenik kemirgen modelleri geliştirilmiştir. Nörotoksin 6-hidroksidopamin kullanımı, siyah maddeye enjekte edildiğinde nigrostriatal yoldaki dopaminerjik nöronları hedefleyerek ve yok ederek sıçanlarda bir PD modeli oluşturur.
Gen tedavisi
Gen tedavisi tipik olarak, genetik materyali beynin bir kısmına mekik için bulaşıcı olmayan bir virüsün (yani, adeno-ilişkili virüs gibi bir viral vektörün ) kullanımını içerir. Birkaç yaklaşım denenmiştir. Bu yaklaşımlar, hasarı önlemeye çalışmak için büyüme faktörlerinin ekspresyonunu ( Neurturin – bir GDNF- ailesi büyüme faktörü) ve glutamik asit dekarboksilaz ( GAD – GABA üreten enzim ), tirozin hidroksilaz (L üreten enzim) gibi enzimleri içermiştir. -DOPA) ve katekol-O-metil transferaz (COMT - L-DOPA'yı dopamine dönüştüren enzim). Bildirilen herhangi bir güvenlik endişesi yoktur, ancak yaklaşımlar, faz 2 klinik deneylerinde büyük ölçüde başarısız olmuştur. YAB'nin verilmesi, 2011'deki faz 2 denemelerinde umut vaat etti, ancak motor işlevi iyileştirmede etkili olmakla birlikte, DBS'den daha düşüktü. Aynı kohorttaki takip çalışmaları, kalıcı iyileşme önermiştir.
Nöroprotektif tedaviler

Nöroproteksiyon üzerine araştırmalar, PD araştırmalarının ön saflarında yer almaktadır. Potansiyel tedaviler olarak birkaç molekül önerilmiştir. Bununla birlikte, bunların hiçbirinin dejenerasyonu azalttığı kesin olarak kanıtlanmamıştır. Şu anda araştırılmakta olan ajanlar arasında antiglutamaterjikler , monoamin oksidaz inhibitörleri ( selejilin , rasagilin ), promitokondriyaller ( koenzim Q10 , kreatin ), kalsiyum kanal blokerleri ( isradipin ) ve büyüme faktörleri ( GDNF ) bulunmaktadır. Alfa-sinüklein patolojisini azaltmak , klinik öncesi araştırmaların ana odak noktasıdır. İnsan bağışıklık sistemini alfa-sinükleini yok etmeye hazırlayan bir aşı olan PD01A (Avusturya şirketi Affiris tarafından geliştirildi), klinik denemelere girdi ve 2020'de bir faz 1 raporu güvenlik ve tolere edilebilirlik önerdi. 2018'de, bir antikor, PRX002/RG7935, aşama I denemelerinde, aşama II denemelerine devam edilmesini destekleyen ön güvenlik kanıtı gösterdi.
Hücre bazlı tedaviler
1980'lerin başlarından bu yana, fetal , domuz , karotis veya retinal dokular, hücre nakillerinde kullanılmıştır , burada ayrışmış hücreler, dopaminin yerini alacak şekilde kendilerini beyne dahil edecekleri umuduyla substantia nigra'ya enjekte edilir. kaybolan hücreleri üretir. Bu doku kaynaklarının yerini büyük ölçüde uyarılmış pluripotent kök hücre kaynaklı dopaminerjik nöronlar almıştır, çünkü bunun daha uygun bir doku kaynağını temsil ettiği düşünülmüştür. İlk kanıtlar, mezensefalik dopamin üreten hücre nakillerinin faydalı olduğunu gösterdi , ancak bugüne kadar çift kör denemeler uzun vadeli bir fayda belirlemedi. Ek bir önemli sorun, nakledilen doku tarafından diskineziye yol açan aşırı dopamin salınımıydı . 2020'de, insan klinik denemesinde bir ilk olarak, indüklenmiş pluripotent kök hücrelerin PD'den muzdarip bir kişinin beynine nakledildiğini bildirdi.
Başka
Tekrarlayan transkraniyal manyetik stimülasyon , levodopa kaynaklı diskinezileri geçici olarak iyileştirir. PD'deki kullanışlılığı açık bir araştırma konusudur. Muhtemel tedaviler olarak çeşitli besinler önerilmiştir; ancak vitaminlerin veya gıda katkı maddelerinin semptomları iyileştirdiğine dair bir kanıt yoktur . Akupunktur ve Qigong veya T'ai chi uygulamasının hastalığın seyri veya semptomları üzerinde herhangi bir etkisi olduğuna dair hiçbir kanıt yoktur .
PD'de bağırsak-beyin ekseninin ve bağırsak florasının rolü , 2010'larda, PD'li insanlardan fekal transplantasyonların daha kötü sonuçlara sahip olduğu mikropsuz transgenik farelerde yapılan çalışmalardan başlayarak bir çalışma konusu haline geldi . İnsanlarda yapılan bazı araştırmalar, Parkinson hastalarında bağırsak florasındaki disbiyoz kalıpları arasında bir korelasyon olduğunu göstermiştir ve bu kalıplar, kabızlığın ciddiyet ölçüsüyle birlikte, %90 özgüllükle ancak yalnızca %67 duyarlılıkla PD'yi teşhis edebilir. 2017 itibariyle, bazı bilim adamları bağırsak florasındaki değişikliklerin PD patolojisinin erken bir bölgesi olabileceğini veya patolojinin bir parçası olabileceğini varsaydılar. Kanıtlar, bağırsak mikrobiyotasının α-sinükleinin normal işlevine müdahale eden lipopolisakkarit üretebildiğini göstermektedir .
Parkinson için yeni ilaçlar için bir yol olarak adenosin reseptörlerinin (özellikle A 2A ) antagonistlerini araştırmak için girişimlerde bulunulmuştur . Bunlardan istradefylline en başarılı ilaç olarak ortaya çıkmıştır ve 2019 yılında Amerika Birleşik Devletleri'nde tıbbi kullanım için onaylanmıştır. Levodopa/karbidopa rejimine ek tedavi olarak onaylanmıştır.
Referanslar
Dış bağlantılar
- Parkinson Hastalığı at Curlie
- Parkinson Hastalığı: Araştırma Yoluyla Umut (Ulusal Nörolojik Bozukluklar ve İnme Enstitüsü)
- Dünya Parkinson Hastalığı Derneği
- PDGENE – Parkinson Hastalığı genetik ilişkilendirme çalışmaları için veri tabanı
| sınıflandırma | |
|---|---|
| Dış kaynaklar |
|