Ozanimod - Ozanimod
 | |
 | |
| Klinik veriler | |
|---|---|
| Ticari isimler | zepozia |
| Diğer isimler | RPC-1063 |
| AHFS / Drugs.com | Monografi |
| MedlinePlus | a620029 |
| Lisans verileri | |
| Hamilelik kategorisi |
|
Yönetim yolları |
Ağızla |
| ATC kodu | |
| Hukuki durum | |
| Hukuki durum | |
| Farmakokinetik veriler | |
| Eliminasyon yarı ömrü | 19 saat |
| tanımlayıcılar | |
| |
| CAS numarası | |
| PubChem Müşteri Kimliği | |
| İlaç Bankası | |
| Kimyasal Örümcek | |
| ÜNİİ | |
| fıçı | |
| ECHA Bilgi Kartı |
100.247.081 |
| Kimyasal ve fiziksel veriler | |
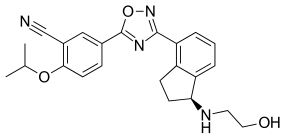
| formül | C 23 H 24 N 4 O 3 |
| Molar kütle | 404.470 g·mol -1 |
| 3B model ( JSmol ) | |
| |
| |
Zeposia markası altında satılan Ozanimod , tekrarlayan multipl skleroz (RMS) ve ülseratif kolit tedavisi için immünomodülatör bir ilaçtır . Bir sfingosin-1-fosfat (S1P) reseptör agonisti olarak işlev görür , lenfositleri periferik lenfoid organlara ve kronik inflamasyon bölgelerinden uzaklaştırır.
En yaygın advers reaksiyonlar üst solunum yolu enfeksiyonu, hepatik transaminaz yüksekliği, ortostatik hipotansiyon, idrar yolu enfeksiyonu, sırt ağrısı ve hipertansiyondur.
Ozanimod, Mart 2020'de Amerika Birleşik Devletleri'nde, Mayıs 2020'de Avrupa Birliği'nde ve Temmuz 2020'de Avustralya'da tıbbi kullanım için onaylanmıştır.
Tıbbi kullanımlar
Amerika Birleşik Devletleri'nde, ozanimod olduğu gösterilen çoklu skleroz (MS) tekrarlayan formları olan yetişkinlerin tedavisi için, klinik olarak izole edilmiş sendromu, nükseden-düzelen hastalığa ve aktif sekonder progresif hastalığı dahil etmek; ve orta ila şiddetli aktif ülseratif kolit (UC) ile.
Avrupa Birliği'nde ve Avustralya'da ozanimod, relapsing remitting multiple sclerosis (RRMS) olan yetişkinlerin tedavisi için endikedir.
Farmakoloji
farmakodinamik
Ozanimod, S1P1 ve S1P5 reseptörlerinin bir agonistidir. Bu etkiyi, üç karşılaştırıcıya 10 kat potansiyel ile doza bağlı bir şekilde gösterir. Bu, 5 izotipin tümüne özgü olmayan selefi fingolimod'a göre seçicilikte bir gelişmedir . S1P'nin agonizmi , doğrudan ubikuitin -proteozom yolu yoluyla içselleştirilmesine ve bozulmasına neden olur . S1P kaybı, dolaşımdaki toplam lenfosit sayısında, özellikle CD4+ CCR7+ ve CD8+ CCR7+ T hücrelerinde azalmaya yol açar .
farmakokinetik
Ozanimod, yüksek bir oral biyoyararlanım, yaklaşık 19 saatlik dolaşımdaki bir yarı ömre sahiptir ve yaklaşık 6 saat sonra en yüksek kan plazma konsantrasyonlarına ulaşır. Ozanimod, iki CYP enzimi tarafından tümü benzer farmakokinetik özelliklere sahip iki aktif metabolite dehidrojene edilir. Lenfosit sayısındaki azalma, tedavinin kesilmesinden sonra yaklaşık 14 gün sürer. Fingolimodun aksine, aktivasyon için fosforilasyon gerektirmez ve kardiyak anormallikler veya hepatotoksisite göstermez.
Tarih
Ozanimod, The Scripps Research Institute tarafından keşfedildi ve Celgene Corp tarafından satın alınan ve daha sonra Bristol Myers Squibb tarafından satın alınan biyoteknoloji şirketi Receptos Inc.'e lisanslandı .
ABD Gıda ve İlaç Dairesi (FDA), tekrarlayan multipl skleroz formları olan 1767 denek üzerinde yapılan iki klinik çalışmadan (Deneme 1/NCT02294058 ve Deneme 2/ NCT02047734) elde edilen kanıtlara dayanarak ozanimod'u onayladı. Denemeler Amerika Birleşik Devletleri, Beyaz Rusya, Polonya, Rusya ve Ukrayna'daki 173 merkezde gerçekleştirildi. Denekler, bir yıla kadar (Deneme 1'de) veya iki yıla kadar (Deneme 2'de) ozanimod veya karşılaştırıcı ( interferon β1a , tekrarlayan multipl skleroz formlarının tedavisi için onaylanmış bir ürün) aldı. Ne denekler ne de sağlık hizmeti sağlayıcıları, denemeler tamamlanana kadar hangi tedavinin verildiğini bilmiyordu. Ozanimod'un yararı, interferon β1a ile tedavi edilen deneklere kıyasla hastalık nüksetmesinde azalma yaşayan deneklerin yüzdesine dayalı olarak değerlendirilmiştir.
Mayıs 2021'de FDA, orta ila şiddetli aktif ülseratif kolit tedavisi için ek bir gösterge için ozanimod'u onayladı.
Klinik denemeler
Mihenk taşı
Touchstone, ülseratif kolit tedavisi için çift kör, plasebo kontrollü bir faz II kliniktir. 18-75 yaş arası, orta ila şiddetli UC'si (Mayo Skoru 6-10) olan 197 hasta alındı ve plasebo, 0.5 mg veya 1 mg oral ozanimod ve ardından 1 haftalık doz artırımı uygulandı. 1 mg doz, plaseboya kıyasla UC'nin klinik remisyon oranında hafif bir artış ve toplam lenfosit azalması gösterdi, en yaygın yan etkiler baş ağrısı ve anemiydi. Yazarlar, bu çalışmadaki sınırlamaların kısa bir süreyi ve küçük örnek boyutunu içerdiğini, yani güvenlik veya etkinliği değerlendiremediklerini belirtti.
parlaklık
Radiance, tekrarlayan multipl skleroz tedavisi için çift kör, plasebo kontrollü bir faz kombine II/III klinik çalışmadır. Faz II denemesi için 18-55 yaşları arasında RMS'li (Ortalama Genişletilmiş Engellilik Durum Ölçeği 2.9) 258 hastaya plasebo, 0.5 mg veya 1 mg oral ozanimod ve ardından 1 haftalık doz artırımı uygulandı. Ozanimod, 24 haftalık bir süre boyunca tekrarlayan multipl sklerozlu katılımcılarda MRG lezyon aktivitesini önemli ölçüde azalttı. Her iki ozanimod dozu, beklenen %60-70 azalmış lenfosit sayısı aralığına ulaştı ve sağlıklı gönüllülerde önceki faz 1 çalışmasıyla tutarlı bir güvenlik profili ile iyi tolere edildi. Plaseboya kıyasla en yaygın yan etkiler şunlardı: nazofarenjit, baş ağrısı ve idrar yolu enfeksiyonları, ciddi enfeksiyöz veya kardiyak yan etkiler olmadan. Bu sonuçlarla, her iki ozanimod dozu da 2 yıllık uzun faz III çalışmasına alındı ve tamamlandı, ancak Kasım 2016 itibariyle yayınlanmadı.
güneş ışını
Sunbeam, tahmini 1200 hasta büyüklüğünde, optimum güvenlik-fayda ilişkisine sahip dozu belirleyen ikinci RMS faz III klinik araştırmasıdır. Kasım 2014'te başlamıştır ve tahmini tamamlanma tarihi Şubat 2017'dir.
Toplum ve kültür
Ticari
Mayıs 2013'te halka açıldıktan sonra, Receptos, Inc. hissesi, ozanimod'un bir S1P immünomodülatör ilaç olarak görüntülenen klinik verileriyle yükseldi. Ağustos 2015'te, Receptos, Celgene tarafından eldeki nakit ve yeni borç kombinasyonu yoluyla 7.2 milyar dolara satın alındı ve hisse değerinde %22'lik bir artışa yol açtı. Receptos, Inc. (Celgene), Temmuz 2016'da ozanimod sentezinin patentini aldı. Celgene'in iltihaplanma ve immünoloji profilinin genişlemesiyle birlikte, şirket ozanimod'dan yıllık 4 ila 6 milyar dolar satış elde etmeyi bekliyordu; ancak FDA, Şubat 2018'de ilacın onayına yönelik başvurusunu reddetti. Celgene Mart 2019'da yeniden başvuruda bulundu. Yeni sahibi olarak Bristol Myers Squibb, tekrarlayan yetişkinleri tedavi etmek için ozanimod (Zeposia) oral kapsülleri için 26 Mart 2020'de FDA onayını aldı. tekrarlayan-düzelten MS (RRMS), aktif sekonder progresif MS (SPMS) ve klinik olarak izole edilmiş sendrom (CIS) dahil olmak üzere multipl skleroz (MS) formları. Ozanimod, Avrupa Birliği'nde Mayıs 2020'de ve Avustralya'da Temmuz 2020'de tıbbi kullanım için onaylanmıştır.
Araştırma
Ozanimod, ülseratif kolit ve Crohn hastalığı dahil olmak üzere ek immün-inflamatuar endikasyonlar için geliştirilmektedir.
Referanslar
Dış bağlantılar
- "Ozanimod" . İlaç Bilgi Portalı . ABD Ulusal Tıp Kütüphanesi.
- "Ozanimod hidroklorür" . İlaç Bilgi Portalı . ABD Ulusal Tıp Kütüphanesi.
- Klinik çalışma sayısı NCT02047734 de için "Multipl Skleroz (Radiance) Relaps içinde Ozanimod Etkinliği ve Güvenliği Çalışması" ClinicalTrials.gov
- Klinik çalışma sayısı NCT02435992 kısmındaki "Şiddetli Ülseratif Kolit için Orta için RPC1063 Güvenlik ve Etkinliği Deneme" için ClinicalTrials.gov
