Bcr-Abl tirozin-kinaz inhibitörü - Bcr-Abl tyrosine-kinase inhibitor
Bcr-Abl tirozin-kinaz inhibitörleri ( TKI ), kronik miyeloid lösemili (KML) hastaların çoğu için birinci basamak tedavidir . KML vakalarının %90'ından fazlasına, Philadelphia kromozomu adı verilen bir kromozomun oluşumuyla sonuçlanan bir kromozomal anormallik neden olur . Bu anormallik 1960 yılında Peter Nowell tarafından keşfedilmiştir ve kromozom 9'daki Abelson ( Abl ) tirozin kinaz geni ile kromozom 22'deki kırılma noktası kümesi ( Bcr ) geni arasındaki füzyonun bir sonucu olup , kimerik bir onkogen ( Bcr-Abl ) ile sonuçlanır. ve KML'nin patogenezinde yer alan yapısal olarak aktif bir Bcr-Abl tirozin kinaz . Tirozin kinazı seçici olarak inhibe etmek için bileşikler geliştirilmiştir.
2001 ABD Gıda ve İlaç Dairesi'nin (FDA) imatinib onayından önce, KML'nin doğal ilerlemesini değiştirecek hiçbir ilaç mevcut değildi. Sadece busulfan , hidroksiüre veya interferon- alfa (rIFN-a) gibi sitotoksik ilaçlar kullanıldı. İlk Bcr-Abl TK inhibitörü, Time dergisi tarafından kanseri tedavi etmek için "sihirli kurşun" olarak adlandırılsa da , daha sonra ortaya çıkan ilk dirençle mücadele etmek için ikinci nesil bir Bcr-Abl TKI geliştirildi .
Yeni direnç biçimleri şu şekilde ortaya çıkabilir: Abl kinaz alanı içindeki yanlış anlamlı mutasyonlar , Bcr-Abl'nin aşırı ekspresyonu, transmembran plazma proteinlerinin artan üretimi veya Src ailesi kinazlar gibi aşağı akış sinyal moleküllerinin yapıcı aktivasyonu .
Tarih
KML'nin iyi tanımlanmış bir moleküler hedefi ve bu hedefe yönelik nispeten seçici tedavileri vardır ki bu, günümüzde çoğu kanser ve kemoterapi için geçerli değildir . Bcr-Abl, Bcr-Abl füzyon geninin yapısal olarak aktive edilmiş bir kinazı kodladığı için ilaç müdahalesi için oldukça çekici bir hedef olarak kabul edildi . Tek bir kinazın ATP bağlanma bölgesini spesifik olarak hedef alan ilaç keşfi, insan genomunda yüzlerce protein kinaz bilindiği için oldukça zorlu bir görev olarak görülüyordu . TKI varlığında ATP'nin bağlanması bloke edilir, fosforilasyon önlenir ve Bcr-Abl eksprese eden hücreler ya seçici bir büyüme dezavantajına sahiptir ya da apoptotik hücre ölümüne maruz kalır .
İmatinib'e artan direnç ve hoşgörüsüzlük nedeniyle, Bcr-Abl tirozin kinazı inhibe edebilecek yeni ilaçlar geliştirmek için çaba gösterildi. Bu, ikinci nesil ilaçların keşfine yol açtı. İmatinib geliştirmek için ilaç taraması kullanılırken , Bcr-Abl tirozin kinazın yapısal biyolojisinde artan bilgi nedeniyle rasyonel ilaç tasarımı yaklaşımıyla ikinci nesil TKI'ler geliştirilmiştir .
Birinci nesil
İmatinib (STI571)
İmatinib (Gleevec) 1992 yılında keşfedilmiştir ve KML tedavisinde kullanılan ilk Bcr-Abl tirozin kinaz inhibitörü olduğu için birinci nesil ilaç olarak kabul edilmektedir.
Gelişim
İmatinib gelişiminde Bcr-Abl tirozin kinazın yapısı bilinmediği için sınırlı bir rol oynamıştır. Bir yüksek verimli tarama kimyasal kütüphanelerin Novartis denilen bir başlangıç molekülü tespit etmek gerçekleştirilmiştir pirimidin bir şekilde görev Bu bileşik A öncü bileşim ve daha sonra test edilmiş ve imatinib geliştirmek için modifiye edilmiştir. Bir yedek ile imidazol onun sırasında benzamido grubuyla grubu, bileşiğin özgüllük artan aktivite , bir kinaz inhibitörü olarak aynı kalmıştır. Daha sonra, pirimidinil-amino grubuna bir metil ikame edicisi orto eklenmesi, gücü arttırdı .
bağlama
O zamandan beri kristalografik çalışmalar , imatinib'in Abl'nin kinaz alanına yalnızca alan etkin olmayan veya "kapalı" yapıyı benimsediğinde bağlandığını ortaya koymuştur . Burası, glisin bakımından zengin, P-bağlayıcı fosfat döngüsünün (P-halkası) ATP bağlanma bölgesi üzerinde katlandığı ve aktivasyon döngüsünün, substrat bağlanma bölgesini kapattığı ve ATP fosfat bağlama bölgesini bozarak, substratı bloke ettiği bir konformasyon benimsediği yerdir. enzimin katalitik aktivitesi. Aktivasyon döngüsünün N-terminal ucundaki Asp Phe Gly (DFG) üçlüsünün kayması, inhibitörler tarafından kullanılabilen bir bağlama cebinin açığa çıkmasıyla sonuçlanır. Bu konformasyona DFGout adı verilir .
İmatinib, altı hidrojen bağı etkileşimi yoluyla Abl alanına bağlanır . Bu, imatinib Bcr-Abl kompleksini stabilize eder ve ATP'nin bağlanma bölgesine ulaşmasını önler. Hidrojen bağları içeren piridin -N ve omurga arasında -NH Met -318 amino pirimidin ve yan zincir hidroksil bölgesinin Thr -315, amid-NH ve yan zincir karboksilat ve Glu arasında -286, karbonil ve omurga -NH Asp -381 , Ile -360 ve His -361'in omurga-karbonil atomlarına sahip protonlanmış metil piperazin . Ek olarak, bir dizi van der Waals etkileşimi bağlanmaya katkıda bulunur. Bir hidrofobik cebi tarafından oluşturulan amino asit kalıntılarının Ile-293, Leu -298, Leu-354 ve Val -379 fenil halkası etrafında bitişik piperazinil imatinib -metil grubu. Keşfi sırasında, yapısal bilginin yokluğunda, imatinib'in etkileyici seçiciliği için net bir açıklama bulunamadı.
Birinci kuşak tedavi, KML hastalarında son derece yüksek bir yanıt oranı ve düşük bir nüks oranı elde etmesine rağmen, bazı hastalarda imatinib'e direnç veya intolerans görülür.
İlaç direnci
İlaç direnci , Bcr-Abl TKI'nin devam eden araştırma ve geliştirmesindeki ana itici güçtür. İmatinib'in piyasaya sürülmesinden kısa bir süre sonra, araştırmacılar ilaca dirençli bir dizi in vitro türetilmiş hücre dizisini tanımlamaya başladılar . Bunu, hastalardaki imatinib dirençli hücrelerin klinik tanımı takip etti ve bu, bu gözlemlerin arkasındaki biyolojiyi daha iyi anlama çabalarıyla sonuçlandı. KML'li hastalarda imatinib'in terapötik yanıtının değerlendirilmesi, hematolojik , sitojenik ve moleküler kilometre taşlarının karşılanmasına dayanmaktadır . Önceden tanımlanmış kronolojik zaman noktalarında tanımlanmış yanıtları elde edemeyen hastalar, birincil olarak tedaviye dirençli olarak tanımlanır ve hastalık gerilemesinde önceden elde edilen kilometre taşlarını kaybedenler ikincil dirençli olarak tanımlanır. Bir sonuca varmadan önce, geriye dönük verilerin KML hastalarında yüksek bir imatinib uyumsuzluğu insidansı gösterdiğini ve bunun istenmeyen klinik sonuçlara yol açabileceğini düşünmek önemlidir .
Genel olarak, imatinib direnci, Bcr-Abl bağımlı ve bağımsız mekanizmalara bölünebilir. Bcr-Abl bağımlı mekanizmalar , Bcr-Abl geninin aşırı ekspresyonu veya amplifikasyonunu ve Bcr-Abl kinaz alanı içindeki imatinib bağlanmasına müdahale eden nokta mutasyonlarını içerir . Bcr-Abl'den bağımsız mekanizmalar, örneğin ilaç akışı ve akışındaki değişiklikler ve Src kinaz ailesinin üyeleri gibi Bcr-Abl'den bağımsız yolların aktivasyonu gibi hücre içindeki imatinib konsantrasyonunu etkileyen faktörleri içerir. İmatinib direnci, klinik veri eksikliği nedeniyle bu mekanizmaların önemi hala bir soru olmaya devam ettiğinden, burada bahsedilmeyecek olan diğer mekanizmalar tarafından da üretilebilir.
Bcr-Abl bağımlı direnç mekanizmaları
Bcr-Abl çoğaltma
İmatinib'e dirençle ilgili ilk raporlar, onkogen amplifikasyonunun gelişimini tanımladı . Yani patojenik Bcr-Abl tirozin kinazı kodlayan gen , DNA dizisinde kopyalanır ve patojenin daha yüksek ekspresyonuna yol açar. İmatinib dozunun arttırılması, şiddetli veya dayanılmaz yan etkilerin meydana gelmemesi koşuluyla, bu tür bir direncin üstesinden gelebilir .
Bcr-Abl mutasyonu
Nokta mutasyonları , Bcr-Abl proteininin kinaz alanı içinde amino asit ikamelerine neden olabilir ve imatinib'in tirozin kinaz üzerindeki bağlanma bölgesini bozarak ilaca duyarlılık kaybına neden olabilir. Bu mutasyonlar normal olarak Bcr-Abl proteininin yapısını etkiler ve ya ilaç ile Bcr-Abl proteini arasındaki kritik temas noktalarının kesilmesine ya da bir konformasyonel değişikliğin indüklenmesine yol açarak imatinib'in bağlanamadığı bir protein ile sonuçlanır.
Mutasyon frekansı hastalığı olarak artırmak için görünür CML gelen gelişmeler kronik fazda için yüksek faz . En önemli mutasyonlar, P-loop mutasyonları ve T315I mutasyonudur. Kinazın diğer bölgelerinde, örneğin C- heliks , SH2 alanı , substrat bağlanma bölgesi, aktivasyon döngüsü ve C-terminal lobu üzerinde mutasyonlar da rapor edilmiştir . Bu mutasyonların bazıları klinik öneme sahiptir, ancak hiçbiri P-loop ve T315I mutasyonları kadar önemli değildir.
T315I mutasyonu
T315I, ponatinib'den önce tüm onaylanmış Bcr-Abl inhibitörlerine direnci nedeniyle benzersiz bir mutasyondur . Bu, tek bir kaynaklanır sitozin için timin (Cı -> T) baz çifti Abl geni (pozisyon 944 de ikame kodonu Abl proteininin '315'), bir amino asit içinde elde edilen sekans (T) hreonine ile ikame edilir , (I) bu konumda sülösin - dolayısıyla 'T315I'. Bu ikame , imatinib ve Abl kinaz arasındaki hidrojen bağı için gerekli olan kritik bir oksijen molekülünü ortadan kaldırır ve ayrıca çoğu TKI'nin bağlanmasına sterik engel oluşturur . Keşfedildiğinde, imatinib direncine sahip 9 ileri evre KML vakasından her 6'sının bu mutasyonu taşıdığı tahmin edilmiştir. T315I, hem imatinib hem de ikinci nesil TKI'lere karşı herhangi bir mutasyonun en yüksek direncini üretir. Ariad tarafından üretilen Ponatinib (Iclusig) , 2013 yılında ikinci basamak KML tedavisi olarak kullanım için onaylanmıştır ve T315I mutasyona uğramış kinaza başarıyla bağlanan tek lisanslı TKI'dir.
P-döngü mutasyonları
Bcr-Abl'nin yapısı, ATP bağlayıcı P-döngüsü ve aktivasyon döngüsü olmak üzere iki esnek döngü içerir . Bu döngüler, bazal konformasyonu stabilize eden Bcr-Abl'nin inaktif konformasyonunda özel düzenlemelere sahiptir. Bu ilmeklerdeki mutasyonlar, kinaz domeninin imatinib bağlanması için gerekli olan inaktif konformasyonu üstlenemeyeceği şekilde ilmeklerin düzenlenmesini kararsız hale getirir. P-loop bölgesindeki mutasyonlar en yaygın olanıdır ve tüm mutasyonların %36-48'ini oluşturur. P-loop'taki Bcr-Abl mutasyonlarının, doğal Bcr-Abl ile karşılaştırıldığında imatinib'e 70-100 kat daha az duyarlı olduğunu gösteren klinik veriler vardır.
Bcr-Abl Bağımsız direnç mekanizmaları
Çeşitli model sistemlerde görülen direnci tanımlamak için ek mekanizmalar varsayılmıştır, ancak hiçbiri klinik direncin tek kaynağı olarak açıkça tanımlanmamıştır.
P-glikoproteinlerin neden olduğu ilaç akışı
Hücre dizilerinde yapılan bazı araştırmalar, imatinib direncinin kısmen P-glikoprotein akış pompasının ekspresyonundaki artıştan kaynaklanabileceğini göstermiştir . P-glikoprotein aktivitesini inhibe eden ajanlar kullanılarak imatinib duyarlılığı bazı durumlarda restore edilmiştir.
Organik katyon taşıyıcı ile ilaç ithalatı 1
İmatinib'in hücrelere girişi, bir organik katyon taşıyıcıya ( OCT1 ) bağlıdır. OCT1, akışını inhibe ederek ve böylece imatinib'in hücre içi biyoyararlanımını azaltarak imatinib direncinde önemli bir rol oynar. OCT1'in düşük ekspresyonu, aktivitesi veya polimorfizmi olan hastalarda, hücre içi imatinib seviyeleri önemli ölçüde daha düşüktü. Düşük OCT1 aktivitesine sahip hastaların yanıtı önemli ölçüde doza bağımlıydı. Bu veriler, OCT1 aktivitesinin, imatinib'e verilen moleküler yanıtta önemli bir belirleyici olduğunu gösterir.
Alternatif sinyal yolu aktivasyonu
Birkaç hasta grubunda dirence, diğer sinyal yollarının, özellikle Src ailesi kinazlarının aktivasyonu neden olabilir. Src ailesi kinazlar, Bcr-Abl sinyalleşmesinde rol oynar ve imatinib'i bağlamayan bir konformasyon olan Bcr-Abl'nin aktif konformasyonunu stabilize ederek imatinib direncine aracılık eder. Ayrıca, artan kanıtlar, Src ailesi kinazlarının, imatinib direncinin Bcr-Abl'den bağımsız formlarında da rol oynadığını göstermektedir.
Çözümler
İmatinib dirençli veya intoleransı olan KML hastaları için tedavi seçenekleri, imatinib dozunun artırılması veya ikinci nesil ilaçların kullanılması gibi stratejileri içerebilir. İmatinib dozlarının artırılmasının, Bcr-Abl duplikasyonu gibi imatinib'e karşı bazı birincil direnç vakalarının üstesinden geldiği gösterilmiştir, ancak yanıt genellikle kısa etkilidir. Direnç veya hoşgörüsüzlük durumunda, değişken seçeneklerin farklı direnç mekanizmalarına karşı farklı fonksiyon profiline sahip olması nedeniyle ikinci basamak tedavi seçimini yönlendirmek için Bcr-Abl mutasyonlarını test etmek yardımcı olabilir. İkinci nesil ilaçlar , dirençli hastalarda daha iyi etki ve daha büyük bir başarı olasılığı sunar. Aynı zamanda , erken evre hastalarda çoklu Abl kinaz inhibitörlerinin uygulanmasının ilaca dirençli klonların ortaya çıkmasını geciktirmek veya önlemek için kullanılabileceği hipotezini test etmeye artan bir ilgi vardır . KML'de yer alan farklı yolları hedefleyen iki ajanın kombinasyonu, yanıt oranlarını önemli ölçüde iyileştirebilir ve potansiyel olarak sağkalımı artırabilir.
İkinci nesil ilaçlar
İkinci nesil ilaçların, imatinib'e göre daha az direnç ve intoleransa sahip olması amaçlanmıştır. Halihazırda pazarlanan ikinci nesil ilaçlar nilotinib, dasatinib, bosutinib ve ponatinib'dir.
Nilotinib (AMN107)
Gelişim
Nilotinib , yapısal olarak imatinib ile ilişkili bir fenilamino-pirimidin türevidir. İmatinib intoleransı ve direnci ile ilişkili ihtiyacı ele almak için Abl-imatinib kompleksinin yapısına dayalı olarak geliştirilmiştir. Bir Bcr-Abl inhibitörü olarak daha güçlü ve seçici hale getirmek için imatinib molekülünde küçük değişiklikler yapıldı ve bu değişiklikler nilotinibin keşfiyle sonuçlandı. Nilotinib, seçici bir Bcr-Abl kinaz inhibitörüdür.
Nilotinib, Bcr-Abl tirozin kinazın aktivitesini ve Bcr-Abl eksprese eden hücrelerin proliferasyonunu inhibe etmede imatinibden 10-30 kat daha güçlüdür . İlaç , KML patogenezinde yer alan Tyr -177 üzerinde Bcr-Abl'nin oto fosforilasyonunu etkili bir şekilde inhibe eder . Birlikte uygulamayı takiben imatinib ve nilotinibin sinerjistik aktivitesi bildirilmiştir. Bu, ilaçların hücrelerde farklı mekanizmalarla alınmasının bir sonucu olabilir: imatinib akışı OCT1'e bağlıdır, ancak nilotinib değildir. Nilotinib ayrıca imatinib'in aksine akış taşıyıcı P-glikoprotein pompası için bir substrat değildir. Bu iki ilacın iki boyutlu moleküler yapıları benzer görünse de uzamsal yapı ve moleküler özellikler açısından birbirlerinden farklıdırlar .

bağlama
Nilotinib, büyük ölçüde lipofilik etkileşimler yoluyla Abl kinaz alanının inaktif konformasyonuna bağlanır ve böylece katalitik aktivitesini bloke eder. Nilotinib , Met-318'in piridil -N ve omurga NH'sini, anilino -NH'yi ve Thr-315'in yan zinciri OH'sini, Glu'nun amido-NH'sini ve yan zincir karboksilatını içeren dört hidrojen bağı etkileşimi yaparak kinaz alanına bağlanır. -286 ve Asp-381'in NH omurgasına sahip amido karbonil. Nilotinibin [4-(3-piridinil)-2-pirimidinil] anilino segmenti, ATP bağlanma sahası içindeki bir bölgenin Met-318, Phe-317 ve Thr-315 kalıntıları ile yakın bağlanma etkileşimlerine sahiptir. Bileşiğin kalan yarısı, ek bir cep içinde bağlanmak için Thr-315 bekçi kalıntısının ötesine uzanır. Nilotinibin 3-metilimidazol ve trifloro-metil grupları, Abl kinaz alanı ile önemli etkileşimler yapar. Bu gruplar ayrıca nilotinibin şeklini imatinib'inkinden çok farklı kılar. Nilotinib ayrıca çok sayıda zayıf van der Waals etkileşimi yoluyla kinaza bağlanır.
Direnç
Nilotinib, imatinib direnciyle ilişkili çoğu mutasyona (32/33) karşı etki göstermiştir, ancak T315I mutantı nilotinibe dirençli kalır. T315I mutantına karşı etkisizliği, nilotinib üzerinde treonin-O ve anilin-NH arasındaki bir H-bağ etkileşiminin kaybının ve nilotinibin izolösin-metil grubu ile 2-metilfenil fenil grubu arasındaki sterik bir çatışmanın bir sonucu gibi görünmektedir. Öte yandan, nilotinibe direnç, çoğunlukla P-loop ve T315I'yi etkileyen sınırlı bir Bcr-Abl kinaz mutasyonu spektrumu ile ilişkilidir. Bununla birlikte, T315I dışındaki tüm mutasyonlar, nilotinib konsantrasyonunun arttırılmasıyla etkili bir şekilde bastırılmıştır. Nilotinib, imatinibden daha güçlü olmasına rağmen, Abl'ye spesifik bağlanma şeklinin, diğer bölgeleri yeni ilaç direnci türlerine karşı savunmasız hale getirmesi mümkündür.
Dasatinib (BMS-354825)
Gelişim
Dasatinib , hidroklorür tuzu olarak geliştirilmiş bir tiazolilaminopirimidindir . İmmünosupresif ilaçlara yönelik bir programla keşfedilmiştir ve vahşi tip Bcr-Abl ifade eden hücrelere karşı imatinib'den 325 kat daha güçlüdür. Dasatinib, Bcr-Abl ve Src ailesi kinazlarının çok hedefli bir inhibitörüdür. Ayrıca, ilave aşağı akış kinazlarına karşı inhibitör aktiviteye sahiptir.
bağlama
Dasatinib, imatinib'den daha az katı konformasyonel gereksinimlerle Abl'ye bağlanır, bu nedenle imatinib ile karşılaştırıldığında artan potens, ancak daha düşük seçicilik sergiler. Dasatinib, diğer birçok TKI'nin yalnızca aktif forma bağlanmasının aksine, Abl kinazın hem aktif hem de aktif olmayan yapısını bağlar. Aktif konformasyonu hedefleyen bileşikler tanımlanmıştır, ancak yüzlerce insan protein kinazının tümünde bağlanma bölgesi çok benzerdir. Bu nedenle, aktif olmayan konformasyonlar arasındaki farklılıklar için oldukça büyük bir kapsam vardır, bu nedenle oldukça seçici kinaz inhibitörlerini keşfetme çabaları, aktif olmayan konformasyona bağlanan moleküllere yöneliktir.
Dasatinib, nilotinib ile ortak bazı yapısal unsurlara, özellikle de aminopirimidin ve karboksamid gruplarının yan yana gelmesine sahiptir . Aminotiyazol dasatinib kademeli bir omurga CO ve Met-318 NH ve bir çift dişli H-bağlama etkileşim yapar amid NH Thr-315 yan zincir oksijen ile bir H-bağı yapar.
Direnç
Dasatinib, Src ailesi kinazlarının bir inhibitörü olduğundan, Src ailesi kinaz aktivasyonu nedeniyle direncin üstesinden gelebilir. İmatinib ile aynı katı konformasyonel gereksinimlerle Bcr-Abl'ye bağlanmadığından, T315I hariç tüm Bcr-Abl kinaz alanı mutantlarını inhibe edebilir. Dasatinib ayrıca imatinib gibi çoklu ilaç P-glikoprotein akış pompalarının bir substratı değildir. Bu nedenle dasatinib, hem imatinib hem de nilotinib ile başarısızlıktan sonra bazı hastalarda aktif olabilir. Dasatinib, imatinibden çok daha güçlü olmasına rağmen, nilotinib'de olduğu gibi, Abl'ye spesifik bağlanma modunun yeni ilaç direnci türleri sağlayabilecek yeni savunmasız bölgelere yol açması mümkündür. Phe317'de mutasyonlar bulundu, bu yüzden bu ilaç için potansiyel bir savunmasız bölge.
Bosutinib (SKI-606)
Gelişim
Bosutinib'in yapısı bir kinolin iskelesine dayanır ve yapısal olarak AstraZeneca kinazolin şablonuyla ilişkilidir . Src kinaza bağımlı maya taraması , bir Src inhibitörü olarak bir 4-anilino-3-kinolin karbonitrilin karakterizasyonuna yol açtı . Bu isabetin özelliklerinin ve ilgili bir bileşiğin kombinasyonu ve çözündürücü grupların eklenmesi , bosutinib'in keşfedilmesine yol açtı. Bir Abl kinaz inhibitörü olduğu öne sürüldü ve bu şekilde test edildiğinde Abl'ye karşı Src'den biraz daha güçlü olduğu ortaya çıktı ( IC50 1,4 nM'ye karşı 3,5 nM ). Bosutinib'in aktivitesi ilk olarak 2001'de tanımlandı ve 2003'te bir Abl kinaz inhibitörü olarak açıklandı. İlk başta bosutinib'in seçici bir Src kinaz inhibitörü olduğuna inanılıyordu, ancak şimdi kinaz inhibisyon profilinin başlangıçta düşünülenden çok daha az kısıtlı olduğu biliniyor. Bosutinib, Src, Abl ve hem tirozin hem de serin-treonin kinazların geniş bir aralığını inhibe eder.
Direnç
Bosutinib, bazıları imatinib direncine yol açan çeşitli mutasyonları eksprese eden hücreleri inhibe etti, ancak T315 mutasyonu bosutinib'e tamamen dirençliydi. İmatinib, nilotinib ve dasatinib'in aksine bosutinib, yabancı moleküllerin hücrelerden dışarı akışını destekleyen çoklu ilaç direnci (MDR) taşıyıcıları için etkili bir substrat değildir . Bosutinib, bu taşıyıcı proteinleri daha yüksek konsantrasyonlarda bile inhibe eder.
Ponatinib (AP24534)
ARIAD Pharmaceuticals , Inc. 10 Eylül 2010'da T315I mutasyonuna karşı etkili oral olarak aktif bir Bcr-Abl TKI olan ponatinib'in bir faz II klinik deney için onaylandığını duyurdu .
Keşfe giden yol, Ariad'ın ATP rekabetçi ikili Src/Abl inhibitörlerinin ilklerinden biri olan AP23464'e bağlanabilir. AP23464, yapı bazlı ilaç tasarımı ve üç ikameli purin analoglarının odaklanmış sentetik kitaplıkları kullanılarak tanımlandı . Bu madde, nanomolar ölçekte birçok yaygın imatinib dirençli Bcr-Abl mutasyonu dahil olmak üzere Src ve Bcr-Abl kinazlarını güçlü bir şekilde inhibe eder. Ancak AP23464, T315I mutasyonunu inhibe etmez, oysa AP24534 (ponatinib) yapar.
Gelişim
Ariad, çift Src/Abl inhibitörleri için pürin çekirdekli şablonların engelleyici olasılıklarını daha fazla araştırmak için son derece güçlü ilaç öncüsü AP23464'ü kullandı. İlk olarak, Abl'nin inaktif konformasyonunda etkili olan maddelerin araştırılmasıyla, pürin çekirdeğindeki nitrojene bağlı yan zincir , önemli hidrojen bağları oluşturarak inaktif konformasyona yüksek bir afiniteye sahip olduğu bilinen bir diarilamid yapısı ile değiştirildi ve kinaz üzerindeki hidrofobik cepleri doldurmak. Ayrıca, bu doğrulamada pürin çekirdeğindeki siklopentil grubunun glisin açısından zengin bir P-halkası ile çarpıştığı ve böylece molekülden ayrıldığı belirlendi. Daha sonra, inhibitör aktivite üzerinde in vitro test ve in vivo oral absorpsiyon deneyleri ile, purin çekirdeği üzerinde C6 üzerinde daha lipofilik, amid bağlı, siklopropil grubunun hem tatmin edici farmakokinetik hem de etkinlik gösterdiği bulundu. Son olarak, imidazol uzantıları eklenerek diarilamid yan zincirinde yapılan değişiklikler, o zamanlar yeni salınan nilotinib yapısından esinlenmiştir. Bu değişiklikler, AP24163 olarak adlandırılan şeyle sonuçlandı. Bu geliştirme döngüsü sırasında Ariad, T315I mutasyona uğramış Bcr-Abl kinaz ile transfekte edilmiş hücrelere karşı birkaç maddeyi test etti ve şaşırtıcı bir şekilde, AP24163'ün doğal Bcr-Abl'nin güçlü inhibisyonunun üzerine makul bir inhibitör etki gösterdiğini buldu.
Bu çığır açan buluşu takiben Ariad, AP24163 bileşiğinin T315I mutasyonuna karşı etkinliğini artırmak için daha fazla araştırmaya başladı. Molekülün T315I mutasyona uğramış Bcr-Abl kinazın ATP bağlanma bölgesine kenetlenmesi , diğer TKI'lere kıyasla purin çekirdeği ve diarilamid yan zinciri arasındaki sterik olarak daha az talepkar bir vinil bağlantısı nedeniyle izolösin ile beklenen sterik çatışmanın mevcut olmadığını ortaya çıkardı . İlk adım, sterik olarak daha az talepkar bir yapı bulmaya çalışmaktı. Önce bir asetilen bağlantısı test edildi, bu da daha yüksek etkiyle, ancak olumsuz farmakokinetikle sonuçlandı. Daha sonra, daha kararlı bir 2-bütin bağlantısı seçildi. Bu bağlantıyı elde etmek için, bir Sonogashira reaksiyonu için bir başlangıç materyali olarak bir imidazol[1,2-a]piridin çekirdeği kullanıldı ; ancak farmakokinetik hala zayıftı. AP24163 geliştirilirken, pürin çekirdeğindeki C8 üzerine bir siklopropan yan zincirinin eklenmesi, olumlu farmakokinetik ile sonuçlandı. Daha sonra birkaç farklı yan zincir test edildi, ancak en iyi sonuçlar hiç yan zincir olmadan elde edildi ve tatmin edici farmakokinetiğe sahip bir madde elde edildi, ancak şimdi T315I'e karşı da azaltılmış etkiye sahip bir madde ortaya çıktı. Gücü tekrar arttırmanın ilk adımı diğer TKİ'lere bakmaktı. İmatinib, Abl kinazın aktivasyon döngüsünde kalıntı Ile-360'ın karbonil oksijen atomu ile bir hidrojen bağı oluşturduğu gösterilen bir terminal metil piperazin grubuna sahiptir. Piperazin halkası aynı zamanda molekülün farmakokinetik özelliklerini daha da geliştirebilen yaygın bir çözündürücü gruptur. Bu spekülasyonlar, Bcr-Abl T315I mutasyona uğramış kinaza karşı inhibitör etkide iki kat artışla doğrulandı ve gümüş astar, maddenin ('19a' olarak adlandırılan) plazma proteinine bağlanmasıydı , azalmış gibi görünüyordu ve aynı ile daha küçük dozlara izin veriyordu. güç. '19a' hem farelerde hem de sıçanlarda iyi oral farmakokinetik sergilerken, aynı zamanda 6.69'da yüksek bölünme katsayısını korudu . Böylece, molekülün lipofilisitesini daha da düşürmeye yönelik girişimlerde, imidazo[1,2-a]piridin çekirdeği üzerinde tek bir karbon atomunun ikamesi yapıldı; bu da şimdi bileşik ponatinib olarak bilinen şeyle sonuçlandı.
bağlama
Ponatinib ve T315I Bcr-Abl mutasyona uğramış kinazın X-ışını kristalografik analizi, imidazo[1,2b] piridazin çekirdeğinin enzimin adenin cebinde bulunduğunu gösterir. Metilfenil grubu, I315'in arkasında hidrofobik bir cep işgal eder, etinil bağlantısı, amino asit ile olumlu van der Waals etkileşimleri oluşturur ve triflorometil grubu, aktif olmayan konformasyon kinaz tarafından indüklenen bir cebe bağlanır. Ayrıca, ponatinbin içinde bulunduğu kinazın yapısında, ilaç ile Tyr-253 ve Phe-382 arasında ilave olumlu van der Waals etkileşimleri vardır. Menteşe bölgesinde Met-318'in omurgası, Asp-381'in omurgası, Glu-286'nın yan zinciri ve Ile-360 ve His'in omurga-karbonil atomları ile protonlanmış metilpiperazin ile beş hidrojen bağı üretilir. -361.
Bu yapı ile ponatinib'in, muhtemelen molekülün bağlantı bölümünün doğrusallığına bağlanabilen nispeten geniş bir kinaz özgüllük profiline sahip olduğu gösterilmiştir. Bu doğrusal yapı ile ilaç, hidrofobik TK kapı bekçisi artıkları ile sterik çatışmalardan kaçınıyor gibi görünmektedir. Buna rağmen, hatta bundan dolayı, ponatinib güçlü bir ilaçtır ve sadece Bcr-Abl TK üzerindeki bilinen mutasyonların çoğunu değil, hepsinden önemlisi T315I'yi hedefler. Bu mutasyon, hem birinci hem de ikinci basamak tedavilerin başarısızlığının ortak bir yolu olarak ortaya çıkmaktadır. Gelişmekte olan diğer T315I inhibitörlerinin aksine, ponatinib Aurora kinazları hedeflemez, bu da onu onlardan açıkça ayırır ve keşfinin önemini vurgular.
Bafetinib (INNO-406)
Lansmanından sonra imatinib tedavisine karşı ortaya çıkan dirençle birlikte, alternatif tedavi çok arandı. Bafetinib , Bcr-Abl kinazındaki çeşitli nokta mutasyonlarına karşı etkinliği olan, daha az yan etkiye sahip ve daha dar kinaz spektrumlu, yani sadece Lyn ve Bcr-Abl olan, imatinib'den daha güçlü bir ilaç yaratma girişiminin ürünüydü .
Gelişim
Bahsedilen kriterlere uygun madde arayışında imatinib'in Abl'ye bağlı kristal yapısı incelenmiştir. Bu, imatinib'in piperazinilmetil grubuna bitişik fenil halkasının etrafında hidrofobik bir cep ortaya çıkardı. Etkinliği artırmak için bu cebi kullanma girişimleri, tek floro , bromo ve kloro ikame edicileri dahil olmak üzere çeşitli hidrofobik grupların eklenmesine yol açtı . Son olarak, 3. pozisyonda bir triflorometil grubunun, imatinib'e göre yaklaşık 36 kat iyileşme ile en iyi sonuçları verdiği bulundu. Şimdi, maddenin çözünürlüğünü sürdürmek için bir hidrofobik grubun eklenmesine karşı çıkılması gerekiyordu. İmatinib-kinaz kompleksinin kristal yapısının daha yakından incelenmesi, Tyr-236'nın imatinib piridin halkasına çok yakın olduğunu ortaya çıkardı, bu da orada daha büyük bir grup için çok az yer olduğunu veya hiç yer olmadığını gösteriyor. Bu akılda tutularak , piridin yerine daha hidrofilik bir pirimidin halkası ikame edildi, bunun çözünürlüğü arttırırken etkinliği aynı veya hatta biraz daha fazla bıraktığı bulundu. Son olarak, imatinib'in piperazin halkasının Ile-360 ve His-361 ile hidrojen bağını geliştirmek için pirrolidin ve azetidin türevleri eklendi. Bu son modifikasyonlardan en umut verici madde NS-187 olarak etiketlendi.
bağlama
İmatinib ve bafetinibin yapısal benzerlikleri nedeniyle Bcr-Abl'ye bağlanmaları da oldukça benzerdir. Tek dikkate değer fark, triflorometil grubu ile Ile-293, Leu-298, Leu-354 ve Val-379 tarafından oluşturulan hidrofobik cep arasındaki hidrofobik etkileşimden gelir. Bu grup ayrıca bafetinib'in Lyn için özgüllüğüyle de ilişkilendirilebilir, çünkü oradaki bağlanma bölgesi Bcr-Abl'dekiyle neredeyse aynıdır.
Bafetinib, hem imatinib dirençli mutasyonların çoğuna (T315I hariç) hem de bazı dasatinib dirençli mutasyonlara karşı etkili olduğu için TKI tedavisindeki yeri vardır. Bafetinib ayrıca Bcr-Abl için nilotinib'den daha fazla (ancak dasatinib'den daha az) afiniteye sahiptir, ancak yalnızca Bcr-Abl ve Src ailesi kinazları Lck ve Lyn'i hedefler; daha az yan etki olasılığını düşündüren rakipsiz özgüllük ile.
CytRx, Mayıs 2010 itibariyle lösemi tedavisi olarak faz II klinik çalışmasında bafetinb'e sahiptir.
1,3,4 tiyadiazol türevleri - Madde 14
Tiazol ve tiyadiazol türevleri ve bunların Bcr-Abl TK'leri inhibe etme yetenekleri biraz ilgi görmüştür.
Gelişim
Bir İtalyan araştırma grubu, dijital tarama yoluyla , ticari olarak temin edilebilen tiyadiazol türevlerinin hem Abl hem de Src kinazları üzerinde orta düzeyde inhibitör etki gösterdiğini keşfetti . 1,3,4 tiyadiazol çekirdeği kullanılarak ve benzen halkaları üzerinde farklı gruplar veya moleküller denenerek, inhibitör özelliklere sahip birkaç farklı madde üretildi. Çekirdeğin esnekliği, hepsi kinazın aktif formuna bağlı olsa da, maddelerin bir dizi yapısının Abl kinazın ATP bölgesine bağlanmasına izin verdi. Bağlanmanın daha ileri düzeyde incelenmesi, toluen yapısına bağlanan kükürtün pozisyonunun, Abl bağlanması açısından önemli bir rol oynadığını ve ayrıca nitrojenin bir tiyadiazolünden yalnızca birinin bir hidrojen bağı oluşturduğunu gösterdi. Ayrıca, yapının bilgisayar analizi, amide bağlı benzen-ketonun daha uygun bir tiyofen halkası ile ikame edilebileceğini gösterdi . Bu analizin, Abl'nin aktif olmayan yapısı olan dasatinib ve Abl'nin kristal yapısının karşılaştırılmasıyla yapıldığı belirtilmelidir, ancak yerleştirme ve yapı analizinden elde edilen bilgiler, madde 14 olarak adlandırılan bir bileşiğin tanımlanmasına yol açmıştır. Abl'ye yüksek bir afinite ile.
bağlama
Madde 14'ün bağlanması kısmen dasatinib'e benzerdir, madde 14'ün aminotiyazol segmenti, Met-318'in omurga CO ve NH'si ile iki dişli bir H-bağ etkileşimi gerçekleştirirken, metoksi- benzen Val tarafından oluşturulan hidrofobik bir cebe güzelce düşer. 256, Ala 253, Lys 271 ve Ala 380. Dasatinib'inkilere benzer bağlanma özellikleri, tiyazol çekirdeklerinden Bcr-Abl TKI'lerin üretilmesi olasılığını öne sürse de, bu araştırmanın sadece bir dasatinib analoğuna yol açıp açmayacağı sorusu hala açık. veya TK'leri engellemenin yeni bir yolu.
Diğerleri
Rebastinib (DCC-2036) Ayrıca TIE-2 ve VEGFR-2'nin bir inhibitörüdür. Lösemiler (T315I Mutasyonlu Ph+ KML) için bir faz 1 klinik deneyi vardır. Metastatik meme kanseri için kombinasyon tedavisinin bir faz 1 klinik denemesindedir.
Asciminib (ABL001), enzimi allosterik olarak inhibe etmek için miristoil cebini hedefleyen Abelson kinazın bir inhibitörüdür. Ağustos 2020 itibariyle, bosutinib'e üstün etkinlik gösteren KML'de (ASCEMBL) bir faz III çalışmasını tamamlamıştır.
Özet
| İlaç | Yapı | H-bağları | H-bağlayıcı amino asitler | bağlama onayı | keşif | 2017 itibariyle durum |
|---|---|---|---|---|---|---|
| İmatinib (STI571) |
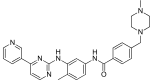
|
6 | Met-318, Thr-315, Glu-286, Asp-381, İle-380, His-361 | etkin değil | İlaç taraması | Birinci basamak tedavi olarak pazarlanan |
| Nilotinib (AMN107) |

|
4 | Met-318, Thr-315, Glu-286, Asp-381 | etkin değil | Akılcı ilaç tasarımı | İkinci basamak tedavi olarak pazarlanır |
| Dasatinib (BMS-345825) |

|
3 | Met-318, Thr-315 | Aktif | Akılcı ilaç tasarımı | İkinci basamak tedavi olarak pazarlanır |
| Bosutinib (SKI-606) |

|
- | - | etkin değil | Akılcı ilaç tasarımı | İkinci basamak tedavi olarak pazarlanır |
| Ponatinib (AP-24534) |

|
5 | Met-318, Asp-381, Glu-286, His-381, İle-380 | etkin değil | Akılcı ilaç tasarımı | İkinci basamak tedavi olarak pazarlanır |
| Bafetinib (INNO-406) |
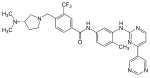
|
6 | Met-318, Thr-315, Glu-286, Asp-381, His-361, Ile-360 | etkin değil | Akılcı ilaç tasarımı | İkinci basamak tedavi olarak pazarlanır |
Mevcut durum - yeniden Ph+ CML
Imatinib, standart bir cephe TKI'si olmaya devam ediyor. Nilotinib ve dasatinib ayrıca FDA tarafından sırasıyla Haziran ve Ekim 2010'da ön saf ilaçlar olarak onaylanmıştır. Bu ilaçlardan dördü, nilotinib, dasatinib, bosutinib ve ponatinib, imatinibe dirençli veya toleranssız KML tedavisi için onaylanmıştır. Bu bileşikler için ilk satır verileri cesaret vericidir ve gelecekte bunların bir kısmının veya tamamının ön hat standardı TKI olarak imatinib'in yerini alabileceğini düşündürmektedir.








