Kinürenin 3-monooksijenaz - Kynurenine 3-monooxygenase
| kinurenin 3-monooksijenaz | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 4J34'ten üretilen kinurenin 3-monooksijenaz dimerinin yapısı. Bir monomer çizgi formatında (camgöbeği) gösterilir ve ikinci monomer şerit formatında (yeşil) gösterilir. Esnek bağlayıcı bölgeler (artık 96-104) kırmızı renktedir. Flavin adenin dinükleotidi (FAD), atom tipine göre renk kodlu küreler olarak gösterilir.
| |||||||||
| tanımlayıcılar | |||||||||
| AB numarası | 1.14.13.9 | ||||||||
| CAS Numarası. | 9029-61-2 | ||||||||
| veritabanları | |||||||||
| IntEnz | IntEnz görünümü | ||||||||
| BRENDA | BRENDA girişi | ||||||||
| ExPASy | NiceZyme görünümü | ||||||||
| fıçı | Fıçı girişi | ||||||||
| MetaCyc | metabolik yol | ||||||||
| PRİAM | profil | ||||||||
| PDB yapıları | RCSB PDB PDBe PDB toplamı | ||||||||
| Gen ontolojisi | AmiGO / QuickGO | ||||||||
| |||||||||
Gelen enzimoloji , bir Kinürenin 3-monooksijenaz ( EC 1.14.13.9 ), bir bir enzim katalize eden kimyasal reaksiyon
Kynurenine 3-monooxygenase, KMO'nun (gen) ekspresyon ürünüdür . Sistematik isim , bu enzim sınıfının bir L oksijen oksidoredüktaz (3-hidroksilasyon): -kynurenine NADPH . Yaygın olarak kullanılan diğer isimler arasında kinurenin 3-hidroksilaz , kinurenin hidroksilaz ve L -kinurenin-3-hidroksilaz bulunur . Kynurenin katabolik yolu yoluyla triptofan metabolizmasına katılır . Bu enzim ailesine aittir Oksidoredüktazların ile, belirli bir eşleştirilmiş donörlere bu tesirli olduğu, O, 2 oksitleyici olarak. Kinürenin 3-monooksijenaz, 3-hidroksi- L -kinürenin üretmek için moleküler oksijenin kinürenin aromatik halkasına eklenmesini katalize eder . Bir kofaktör , FAD kullanır . Kinürenin 3-monooksijenaz, kinürenin yolunda önemli bir dal noktası olarak hizmet eder ve sonuç olarak immünolojik , nörodejeneratif ve nöroinflamatuar hastalıklar için çekici bir ilaç hedefidir . Şu anda, kinurenin 3-monooksijenaz enzimi üzerine yapılan araştırmaların çoğu , her ikisinin de insan kinurenin 3-monooksijenaz proteini ile yüksek sekans homolojisine sahip olduğu gösterilmiş olan sıçan modellerine ve mayaya odaklanmıştır . Çalışmalar, bu ökaryotik kinurenin 3-monooksijenaz aktif bölgelerinde enzim inhibisyonunun faydalı etkilerini göstermiştir, böylece bu enzimi insan ilaç tasarımı için çekici bir hedef haline getirir.
Yapı
Kinürenin 3-monooksijenaz a, dimer asimetrik içeren alt birimi ve protez grubu gibi bir FAD bağlayıcı etki alanına sahiptir. Kynurenin 3-monooksijenaz, bir antiparalel β-tabakanın ikinci bir ipliğini, altı-iplikli bir antiparalel β-yaprak alanını ve karboksi-terminalinde bir α-sarmalını takiben substrat bağlanmasında yer alan bir bağlayıcı bölge içerir . Hidrofobik C-termini, enzimatik aktivite mitokondriyal ankraj alanı ve katılır olarak hareket eder.
Aktif site
Hiçbir bilimsel literatür, L- kinurenin ile bir kinurenin 3-monooksijenaz kompleksinin kristal görüntüsünü rapor etmese de, UPF 648 ile birlikte kristalize edilmiş mayadaki enzimin yapısal çalışmaları, FAD kofaktörünün ve substratın aktif bölgede nasıl bağlandığını ortaya koymaktadır. UPF 648 arasında kimyasal benzerlik L -kynurenine düşündürmektedir bitişik alt-tabaka bağlandığı Re -face flavoprotein. Pro 321 – Gln 325 kalıntılarını içeren bir halkanın , FAD protez grubunun yeniden tarafının üzerindeki oksijen bağlama bölgesi olduğuna inanılmaktadır.
Her monomer , substratın aromatik benzen parçasının etrafına yerleştirilmiş , korunmuş bir hidrofobik cep (Leu 221 , Met 230 , Ile 232 , Leu 234 , Phe 246 , Pro 321 , Phe 322 ) içerir. Korunmuş bir Gln 325 polar kalıntısı, L- kinurenin karbonil grubu üzerindeki hidrojen bağlanmasının yanı sıra FAD N3 atomu üzerindeki hidrojen üzerinde de yer alır. Arg 83 ve Tyr 97 ayrıca substrat üzerindeki amino asit kısmındaki karboksilat ile polar temaslar oluşturur.
mekanizma
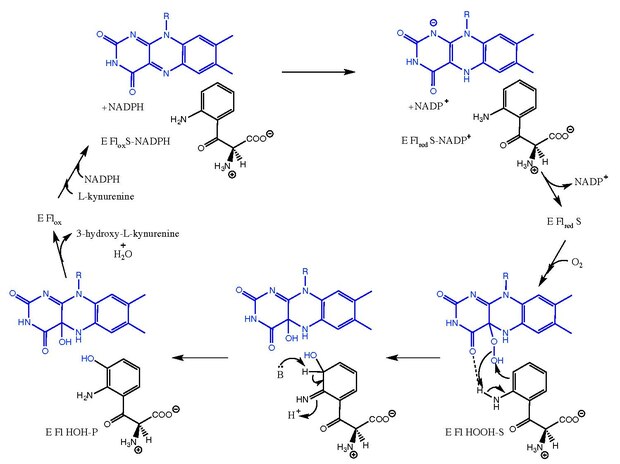
Kinürenin-3-monooksijenaz , L- kinüreninin 3-hidroksi- L -kinürenin'e hidroksilasyonunu katalize eder ve NADPH'nin NADP + 'ya karşılıklı dönüşümü ile birlikte . Reaksiyon mekanizması tam olarak bilinmemektedir, ancak flavin bağımlı monooksijenazlarla ilgili mekanizmaları takip ettiğine inanılmaktadır . L- kinurenin bağlandıktan sonra NADPH, FAD'yi azaltır ve NADP + olarak ayrılır . Oksijen daha sonra bağlanır ve bir L -kinurenin-FAD-hidroperoksit ara maddesini oluşturur. Bu ara ürün, ürünün birincil ketimin formunu ve C4a-hidroksi-FAD'yi veren hidroksilasyon reaksiyonu için elektrofilik kaynaktır . Tatomerizasyon, enzim (E Fl HOH-P) ile kompleks halinde 3-hidroksi- L - kinürenin verir . 3-hidroksi-aynşması L -kynurenine ve H 2 serbest enzime O yol açar (E Fİ ox ).
biyolojik fonksiyon
Kinürenin 3-monooksijenaz, L - kinüreninin , kinürenin yolunda önemli bir biyoaktif metabolit olan 3-hidroksi- L -kinürenin'e dönüşümünü katalize eder . Kynurenin yolu, triptofan oksidatif bozunmasının %95'inden fazlasından sorumludur . L- Kynurenine, kinurenin 3-monooksijenaz yoluyla nörotoksin 3-hidroksi- L -kinürenin'e, kinurenin amino transferazları yoluyla nöroprotektan kinürenik aside veya kinüreninaz tarafından antranilik aside dönüştürülen bu metabolik yolun önemli bir dal noktasıdır .
Kinürenin 3-monooksijenaz , reaktif serbest radikaller üretebilen ve memelilerin merkezi sinir sisteminde eksitotoksik lezyonlar üreten glutamat reseptörlerinin NMDA alt tipini aktive edebilen kinolinik asidin aşağı akış üretimini düzenler . Kinolinik asit aynı zamanda NAD +' ın biyolojik öncüsüdür .
Kinürenin 3-monooksijenazın inhibisyonu, kinürenin yolunda kinürenik asit artışına yol açar. Bir şekilde, bu metabolit fonksiyonlarının antagonist arasında α7 nikotinik asetilkolin reseptörü ve bir şekilde antagonist , NMDA alıcısına ait glisin bölgesi de. Sonuç olarak, kinurenin 3-monooksijenaz enzimindeki düzenleme, kinurenin yolunun nörotoksik ve nöroprotektif potansiyelini belirler.
hastalık alaka
Kinürenin 3-monooksijenaz, özellikle Huntington , Alzheimer ve Parkinson hastalığı olmak üzere çeşitli nörodejeneratif ve nöroinflamatuar hastalıklar için çekici bir ilaç hedefidir . Güçlü enzim inhibitörlerinin uygulanması, umut verici farmakolojik sonuçlar göstermiştir. Spesifik olarak, kinurenin 3-monooksijenaz enziminin genetik eliminasyonunun , Huntington hastalığının maya ve Drosophila modellerinde Huntingtin proteininin toksisitesini baskıladığı gösterilmiştir .
Genetik neden olabilir Kinürenin 3-monooksijenaz eksikliği, polimorfizm , sitokinler birikimine ya da her ikisi, potansiyel kinürenin ve triptofan içinde kayması için metabolik yol kinurenik asit ve doğru antranilik asit . Son zamanlarda yapılan araştırmalar ve hyperphysiologic konsantrasyonları düşündürmektedir kinürenin kinurenik asit üretimine yönelik bir kayma Kinürenin 3-monooksijenaz eksikliği olan hastalarda sonuçları, bilişsel ile ilişkili olduğuna inanılan prediktif takip ve görsel-mekansal çalışma belleği . Kinürenin-3-monooksijenaz eksikliği, beyin (örneğin şizofreni , tik bozuklukları ) ve karaciğer bozuklukları ile ilişkilidir .
Referanslar
- Foucher AL, McIntosh A, Douce G, Wastling J, Tait A, Turner CM (2006). "Trypanosoma brucei'de arsenikli ilaç direncinin proteomik analizi". Proteomik . 6 (9): 2726-2732. doi : 10.1002/pmic.200500419 . PMID 16526094 . S2CID 24074942 .
- Okamoto H, Hayaishi O (1967). "Sıçan karaciğer mitokondri kinurenin hidroksilaz için Flavin adenin dinükleotid gereksinimi". Biyokimya. Biyofiz. Araş. komün . 29 (3): 394–399. doi : 10.1016/0006-291X(67)90469-X . PMID 6076241 .
- Saito Y, Hayaishi O, Rothberg S (1957). "Oksijenaza ile ilgili çalışmalar, 3-hidroksi-enzimatik oluşumu L den -kynurenine L -kynurenine" . J. Biol. Chem . 229 (2): 921-934. doi : 10.1016/S0021-9258(19)63696-3 . PMID 13502353 .