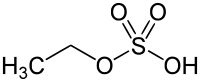
Etil sülfat - Ethyl sulfate
|
|
|
|
| İsimler | |
|---|---|
|
Tercih edilen IUPAC adı
Etil hidrojen sülfat |
|
| Diğer isimler
Etil sülfat; Sulfovinic asit; Etil bisülfat; Etoksisülfonik asit; Etil sülfat
|
|
| Tanımlayıcılar | |
|
3B modeli ( JSmol )
|
|
| ChemSpider | |
| ECHA Bilgi Kartı |
100.007.963 |
|
PubChem Müşteri Kimliği
|
|
| UNII | |
|
CompTox Kontrol Paneli ( EPA )
|
|
|
|
|
|
| Özellikleri | |
| C 2 H 6 O 4 S | |
| Molar kütle | 126,13 g · mol −1 |
| Yoğunluk | 1,46 g / cm³ |
|
Aksi belirtilmedikçe, veriler standart hallerinde (25 ° C [77 ° F], 100 kPa) malzemeler için verilmiştir. |
|
|
|
|
| Bilgi kutusu referansları | |
Etil sülfat (IUPAC adı: etil hidrojen sülfat ) olarak da bilinen, sulfovinic asit , bir bir organik kimyasal bileşik üretiminde bir ara ürün olarak kullanılan etanol gelen etilen . Sülfürik asidin etil esteridir .
Tarih
Bu madde ile eş çalışılmıştır eter ile Almanca simyacı Ağustos Siegmund Frobeniyus tarafından sonradan, 1730 yılında Fransız kimyager Fourcroy 1797 yılında ve Gay-Lussac 1815 yılında İsviçreli bilim adamı Nicolas-Théodore de Saussure de 1827, Fransız 1807 yılında bunu okudu kimyager ve eczacı Felix-Polydore Boullay ile birlikte (1806-1835) Jean-Baptiste Andre Dumas hazırlanmasında etil sülfat rolünü işaret dietil eter den sülfürik asit ve etanol . Alman kimyager Eilhard Mitscherlich ve İsveçli kimyager Jöns Berzelius tarafından yapılan daha ileri çalışmalar, sülfürik asidin bir katalizör görevi gördüğünü ileri sürdü , bu da süreçte sülfovinik asidin bir ara ürün olarak keşfedilmesine yol açtı. Gelişi elektrokimya ile İtalyan fizikçi Alessandro Volta ve İngiliz kimyacı Humphry Davy 1800'lerde eter doğruladı ve su reaksiyonu ile oluşturulmuş bir alt-stokiyometrik etanol sülfürik asit miktarları ve sulfovinic asit tepkime içinde bir ara madde olarak oluşturulmuş olduğu.
Üretim
Etanol , esas olarak, etilenin sülfürik asit ile reaksiyona sokularak etil sülfat üretildiği ve ardından hidroliz edildiği sülfürik asit hidrasyon işlemi ile üretildi , ancak bu yöntem çoğunlukla doğrudan etilen hidrasyonuyla değiştirildi .
Etil sülfat reaksiyona sokulmasıyla bir laboratuvar ortamında üretilebilir etanol ile sülfürik asit , 140 ° C'nin altında reaksiyona tutarken, hafif bir kaynama altında. Sülfürik asit damla damla eklenmelidir veya reaksiyon aktif olarak soğutulmalıdır çünkü reaksiyonun kendisi oldukça ekzotermiktir.
- CH 3 CH 2 , OH + H 2 SO 4 → CH 3 -CH 2 -O-SO 3 H + H 2 O
Sıcaklık 140 ° C'yi aşarsa, etil sülfat ürünü artık etanol başlangıç malzemesi ile reaksiyona girerek dietil eter üretir . Sıcaklık, önemli miktarda sülfürik asitte 170 ° C'yi aşarsa, etil sülfat etilen ve sülfürik aside parçalanır .
Tepkiler
Etil sülfat, dietil eter ve etilen oluşum mekanizması , oksonyum iyonu oluşturmak için etanolik oksijenin protonasyonunu içeren, etanol ve sülfürik asit arasındaki reaksiyona dayanır .
Etil sülfat, kronik alkol tüketiminden sonra saçta birikir ve tespiti alkol tüketiminde biyolojik belirteç olarak kullanılabilir .
Tuzlar
Etil sülfat, sodyum etil sülfat, potasyum etil sülfat ve kalsiyum etil sülfat gibi tuz formlarında mevcut olabilir. Tuz, uygun karbonat veya bikarbonat tuzu ilave edilerek oluşturulabilir. Örnek olarak, etil sülfat ve potasyum karbonat, potasyum etil sülfat ve potasyum bikarbonat oluşturur .
- CH 3 -CH 2 -O-SO 3 H + K 2 CO 3 → CH 3 -CH 2 -O-SO 3 K + KHCO 3
