Piren - Pyrene
|
|

|
|
| İsimler | |
|---|---|
|
Tercih edilen IUPAC adı
piren |
|
| Diğer isimler
Benzo[ tanım ] fenantren
|
|
| tanımlayıcılar | |
|
3B model ( JSmol )
|
|
| 1307225 | |
| chebi | |
| CHEMBL | |
| Kimyasal Örümcek | |
| ECHA Bilgi Kartı |
100.004.481 |
| 84203 | |
| fıçı | |
|
PubChem Müşteri Kimliği
|
|
| RTECS numarası | |
| ÜNİİ | |
|
CompTox Panosu ( EPA )
|
|
|
|
|
|
| Özellikleri | |
| Cı- 16 , H 10 | |
| Molar kütle | 202.256 g·mol -1 |
| Görünüm | renksiz katı
(sarı safsızlıklar genellikle birçok numunede eser seviyelerde bulunur). |
| Yoğunluk | 1.271 g/mL |
| Erime noktası | 145 - 148 °C (293 - 298 °F; 418 - 421 K) |
| Kaynama noktası | 404 °C (759 °F; 677 K) |
| 0.146 mg/L | |
| -147,9 · 10 -6 cm 3 / mol | |
| Tehlikeler | |
| Ana tehlikeler | tahriş edici |
| R cümleleri (modası geçmiş) | 36/37/38-45-53 |
| S-ifadeleri (modası geçmiş) | 24/25-26-36 |
| NFPA 704 (ateş elması) | |
| Alevlenme noktası | yanıcı değil |
| Bağıntılı bileşikler | |
|
İlgili PAH'lar
|
benzopiren |
|
Aksi belirtilmedikçe, veriler standart durumdaki malzemeler için verilmiştir (25 °C [77 °F], 100 kPa'da). |
|
|
|
|
| Bilgi kutusu referansları | |
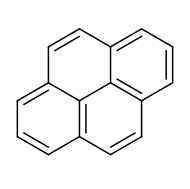
Piren , düz bir aromatik sistemle sonuçlanan dört kaynaşmış benzen halkasından oluşan bir polisiklik aromatik hidrokarbondur (PAH) . Kimyasal formül C'dir
16H
10. Bu sarı katı, en küçük peri-kaynaşmış PAH'dır (halkaların birden fazla yüzeyden kaynaştığı yer). Organik bileşiklerin eksik yanması sırasında piren oluşur .
Oluşum ve özellikler
Piren ilk olarak ağırlıkça %2'ye kadar çıktığı kömür katranından izole edildi. Peri-füzyonlu bir PAH olarak, piren, izomer floranten içeren beş üyeli halkasından çok daha fazla rezonans stabilizedir . Bu nedenle çok çeşitli yanma koşullarında üretilir. Örneğin, otomobiller yaklaşık 1 μg/km üretir.
Reaksiyonlar
Kromat ile oksidasyon, perinaftenon ve ardından naftalen-1,4,5,8-tetrakarboksilik asit verir. Piren, bir dizi hidrojenasyon reaksiyonuna girer ve tümü değişen derecelerde seçiciliğe sahip olan halojenasyona, Diels-Alder ilavelerine ve nitrasyona karşı hassastır . Brominasyon 3 pozisyondan birinde meydana gelir.
Sodyum ile indirgeme radikal anyonu verir. Bu anyondan çeşitli pi-aren kompleksleri hazırlanabilir.
fotofizik
Piren ve türevleri ticari olarak boyalar ve boya öncüleri, örneğin piranin ve naftalen-1,4,5,8-tetrakarboksilik asit yapmak için kullanılır. DCM'de 330 nm'de üç keskin bantta UV-Vis'de güçlü absorbansa sahiptir. Emisyon, absorpsiyona yakındır, ancak 375 nm'de hareket eder. Sinyallerin morfolojisi çözücü ile değişir. Türevleri ayrıca yüksek bir kuantum verimine ve ömrüne sahip olan floresan spektroskopisi yoluyla değerli moleküler problardır ( 293 K'da etanol içinde sırasıyla 0.65 ve 410 nanosaniye ). Piren, excimer davranışının keşfedildiği ilk moleküldü . Bu tür eksimer 450 nm civarında görünür. Theodor Förster bunu 1954'te bildirdi.
Uygulamalar
Pyrene'in floresan emisyon spektrumu solvent polaritesine çok duyarlıdır, bu nedenle solvent ortamlarını belirlemek için bir prob olarak piren kullanılmıştır. Bunun nedeni uyarılmış halinin taban halinden farklı, düzlemsel olmayan bir yapıya sahip olmasıdır. Bazı emisyon bantları etkilenmez, ancak diğerlerinin yoğunluğu, bir çözücü ile etkileşimin gücünden dolayı değişir.

Benzopiren kadar sorunlu olmasa da , hayvan çalışmaları pirenin böbrekler ve karaciğer için toksik olduğunu göstermiştir . Artık pirenin balık ve alglerde çeşitli yaşam fonksiyonlarını etkilediği bilinmektedir.
Domuzlarda yapılan deneyler, oral yoldan verildiğinde idrar 1-hidroksipiren'in pirenin bir metaboliti olduğunu göstermektedir .
Pirenler güçlü elektron verici malzemelerdir ve enerji dönüşümü ve hafif hasat uygulamalarında kullanılabilecek elektron verici-alıcı sistemleri yapmak için çeşitli malzemelerle birleştirilebilir.
Ayrıca bakınız
Referanslar
- ^ Uluslararası Temel ve Uygulamalı Kimya Birliği (2014). Organik Kimyanın Adlandırılması: IUPAC Önerileri ve Tercih Edilen İsimler 2013 . Kraliyet Kimya Derneği . s. 206. doi : 10.1039/9781849733069 . ISBN'si 978-0-85404-182-4.
- ^ a b Senkan, Selim ve Castaldi, Marco (2003) Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, Weinheim'da "Combustion" .
- ^ Gumprecht, WH (1968). "3-Bromopiren". Org. sentez . 48 : 30. doi : 10.15227/orgsyn.048.0030 .
- ^ Kucera, Benjamin E.; Jilek, Robert E.; Brennessel, William W.; Ellis, John E. (2014). "Vanadyum, niyobyum ve titanyumun bis(piren)metal kompleksleri: Geçiş metallerinin izole edilebilir homoleptik piren kompleksleri". Acta Crystallographica Bölüm C Yapısal Kimya . 70 (8): 749-753. doi : 10.1107/S2053229614015290 . PMID 25093352 .
- ^ a b Tagmatarchis, Nikos; Ewels, Christopher P.; Bittencourt, Carla; Arenal, Raul; Pelaez-Fernandez, Mario; Sayed-Ahmad-Baraza, Yuman; Kanton-Vitoria, Ruben (2017-06-05). "MoS2'nin 1,2-ditiyolanlarla İşlevselleştirilmesi: enerji dönüşümü için donör-alıcı nanohibritlere doğru" . NPJ 2D Malzemeler ve Uygulamalar . 1 (1): 13. doi : 10.1038/s41699-017-0012-8 . ISSN 2397-7132 .
- ^ Van Dyke, David A.; Pryor, Brian A.; Smith, Philip G.; Topp, Michael R. (Mayıs 1998). "Fiziksel Kimya Laboratuvarında Nanosaniye Zamanla Çözülen Floresan Spektroskopisi: Çözeltide Piren Eksimerinin Oluşumu". Kimya Eğitimi Dergisi . 75 (5): 615. doi : 10.1021/ed075p615 .
- ^ Forster, Th.; Kasper, K. (Haziran 1954). "Ein Konzentrationsumschlag der Fluoreszenz". Zeitschrift für Physikalische Chemie . 1 (5_6): 275–277. doi : 10.1524/zpch.1954.1.5_6.275 .
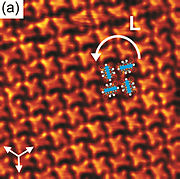
- ^ Pham, Tuan Anh; Song, Fei; Nguyen, Manh-Thuong; Stöhr, Meike (2014). "Au(111) üzerinde piren türevlerinin Kendi kendine montajı: Moleküller arası etkileşimler üzerinde ikame edici etkiler" . Kimya komün . 50 (91): 14089-92. doi : 10.1039/C4CC02753A . PMID 24905327 .
- ^ Oliveira, M.; Ribeiro, A.; Hyland, K.; Guilhermino, L. (2013). "Mikroplastiklerin ve pirenin ortak kaya balığı Pomatoschistus mikroplarının (Teleostei, Gobiidae) yavruları (0+ grup) üzerindeki tek ve birleşik etkileri". Ekolojik Göstergeler . 34 : 641-647. doi : 10.1016/j.ecolind.2013.06.019 .
- ^ Oliveira, M.; Gravato, C.; Guilhermino, L. (2012). "Piren'in Pomatoschistus mikropları (Teleostei, Gobiidae) üzerindeki akut toksik etkileri: Ölüm oranı, biyolojik belirteçler ve yüzme performansı". Ekolojik Göstergeler . 19 : 206-214. doi : 10.1016/j.ecolind.2011.08.006 .
- ^ Oliveira, M.; Ribeiro, A.; Guilhermino, L. (2012). "Mikroplastiklere ve PAH'lara maruz kalmanın mikroalg Rhodomonas baltica ve Tetraselmis chuii üzerindeki etkileri". Karşılaştırmalı Biyokimya ve Fizyoloji Bölüm A: Moleküler ve Bütünleştirici Fizyoloji . 163 : S19–S20. doi : 10.1016/j.cbpa.2012.05.062 .
- ^ Oliveira, M.; Ribeiro, A.; Guilhermino, L. (2012). "Mikroplastiklere ve pirene kısa süreli maruz kalmanın Pomatoschistus mikropları (Teleostei, Gobiidae) üzerindeki etkileri". Karşılaştırmalı Biyokimya ve Fizyoloji Bölüm A: Moleküler ve Bütünleştirici Fizyoloji . 163 : S20. doi : 10.1016/j.cbpa.2012.05.063 .
- ^ Keimig, SD; Kirby, KW; Morgan, DP; Keiser, JE; Hubert, TD (1983). "Domuz idrarında pirenin ana metaboliti olarak 1-hidroksipirenin tanımlanması". Ksenobiyotik . 13 (7): 415–20. doi : 10.3109/00498258309052279 . PMID 6659544 .
daha fazla okuma
- Birks, JB (1969). Aromatik Moleküllerin Fotofiziği . Londra: Wiley.
- Valeur, B. (2002). Moleküler Floresan: İlkeler ve Uygulamalar . New York: Wiley-VCH.
- Birks, JB (1975). "Eksimerler". Fizikte İlerleme Raporları . 38 (8): 903-974. doi : 10.1088/0034-4885/38/8/001 . ISSN 0034-4885 .
- Fetzer, JC (2000). Büyük Polisiklik Aromatik Hidrokarbonların Kimyası ve Analizi . New York: Wiley.