Alveolar makrofaj - Alveolar macrophage

Bir alveoler makrofaj , pulmoner makrofaj , (ya da toz hücre ) bir tür makrofaj , bir meslek fagosit , solunum yollarında ve seviyesinde bulunan alveoller içinde akciğer , ancak kendi duvarları ayrılır.
Alveolar makrofajın aktivitesi nispeten yüksektir, çünkü bunlar vücut ve dış dünya arasındaki ana sınırlardan birinde bulunurlar. Toz veya mikroorganizma gibi partiküllerin solunum yüzeylerinden uzaklaştırılmasından sorumludurlar .
Alveolar makrofajların sıklıkla solunum yüzeylerinden aldıkları partiküler karbon gibi eksojen materyal granülleri içerdiği görülür . Bu tür siyah granüller, özellikle sigara içenlerin ciğerlerinde veya uzun süreli şehir sakinlerinde yaygın olabilir .
Alveolar makrofaj, alveoldeki üçüncü hücre tipidir, diğerleri ise tip I ve tip II pnömositlerdir .
Pigmentli pulmoner makrofajların karşılaştırılması
| Hastalık | makrofaj adı | Makrofaj pigment görünümü (HE boyası) | Her zamanki makrofaj konumu | İlişkili tıbbi geçmiş | resim | Resim yorumu |
|---|---|---|---|---|---|---|
| antrakoz | Siyah-kahverengi granüller | İnterstisyum (perivasküler) |
|
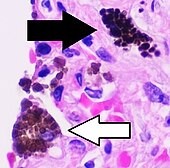
|
Siyah ok, interstisyel antrakotik pigmenti gösterir. Yakındaki makrofajların (beyaz ok) antrakotik pigment içerdiği varsayılabilir. | |
| solunum bronşiolit | "Sigara içenlerin makrofajları" | Sarı ila açık kahverengi ve ince taneli | Hava yolları (özellikle solunum bronşiyolleri) | Tütün içmek |
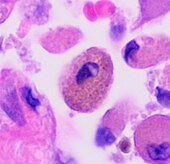
|
Merkezde sigara içen makrofaj |
| Kronik pulmoner tıkanıklık | yanofajlar | Kahverengi-altın ve kırılmaz. | alveoller |
|

|
Siderofaj (siyah ok) ve ödemli interstisyum, hemosiderin birikimi (siyah ok) ve kalp yetmezliğini gösteren kolajen kalınlaşması. |

İşlev


Alveolar makrofajlar, homeostaz, konak savunması ve doku yeniden şekillenmesinde kritik bir rol oynayan fagositlerdir. Nüfus yoğunluğu, bu birçok süreç için belirleyicidir. Oldukça uyarlanabilirler ve birkaç yüzey reseptörü kullanarak diğer hücreler ve moleküller ile etkileşime girmek için birçok salgı salabilirler . Alveolar makrofajlar, apoptotik ve nekrotik hücrelerin fagositozunda da rol oynarlar. Normal hücreleri ve yapıları korumak için fagosite edilen materyali seçmeleri gerekir. Enfeksiyonla mücadele etmek için fagositler, patojenik mikroorganizmaların yüzeyindeki patojenle ilişkili moleküler paternlerin (PAMP'ler) tanınmasına yardımcı olmak için birçok patern tanıma reseptörünü (PRR'ler) kolaylaştırır. PAMP'lerin tümü, bir grup patojene özgü olma, ancak temel yapılarında değişmez olma ortak özelliklerine sahiptir; ve patojenite (bir organizmanın başka bir organizmada bulaşıcı bir hastalık üretme yeteneği) için esastır. Mikrobiyal örüntü tanımada yer alan proteinler arasında mannoz reseptörü, kompleman reseptörleri, DC-SIGN, Toll benzeri reseptörler (TLR'ler), çöpçü reseptör, CD14 ve Mac-1 yer alır. PRR'ler üç sınıfa ayrılabilir:
- hücresel aktivasyona yol açan gen transkripsiyonel mekanizmalarını aktive eden sinyal PRR'leri,
- patojen bağlama ve fagositozda işlev gören endositik PRR'ler ve
- genellikle opsoninler veya kompleman aktivatörleri olarak işlev gören salgılanmış PRR'ler.
İstilacı mikroorganizmaların tanınması ve temizlenmesi hem opsonine bağımlı hem de opsoninden bağımsız yollardan gerçekleşir. Opsonine bağımlı fagositozu kolaylaştıran moleküler mekanizmalar, spesifik opsonin/reseptör çiftleri için farklıdır. Örneğin, IgG ile opsonize edilmiş patojenlerin fagositozu, Fcy reseptörleri (FcyR) aracılığıyla meydana gelir ve mikrop etrafındaki fagosit uzantılarını içerir, bu da proinflamatuar mediatörlerin üretimi ile sonuçlanır. Tersine, tamamlayıcı reseptör aracılı patojen alımı, gözlemlenebilir zar uzantıları olmadan gerçekleşir (partiküller sadece hücreye girer) ve genellikle bir enflamatuar aracı tepkisi ile sonuçlanmaz.
İçselleştirmenin ardından, mikrop bir veziküler fagozom içine alınır ve bu daha sonra birincil veya ikincil lizozomlarla füzyona uğrayarak bir fagolizozom oluşturur. Hücre içi öldürmeye yol açan çeşitli mekanizmalar vardır; oksidatif süreçler vardır ve diğerleri oksidatif metabolizmadan bağımsızdır. İlki, oksijen alımının (solunum patlaması olarak bilinir) uyarılmasına yol açan membran enzim sistemlerinin aktivasyonunu ve mikroorganizmalar için oldukça toksik olan moleküler türler olan reaktif oksijen ara maddelerine (ROI'ler) indirgenmesini içerir. Solunum patlamasının ortaya çıkmasından sorumlu enzim, beş alt birimden oluşan nikotinamid adenin dinükleotid fosfat (NADPH) oksidaz olarak bilinir. Bir bileşen, gp91phox ve p22phox olmak üzere iki protein alt biriminden oluşan bir membran sitokromdur; kalan üç bileşen sitozolik türevli proteinlerdir: p40phox, p47phox ve p67phox. NADPH oksidaz, hareketsiz bir durumdayken AM'nin sitozolünde bulunur; ancak aktivasyon üzerine, sitozolik bileşenlerinden ikisi, p47phox ve p67phox, tirozin ve serin kalıntıları fosforile edilir, bunlar daha sonra NADPHox'un sitokrom bileşenine, gp91phox/p22phox'a hücre iskeleti elemanları yoluyla plazma membranında translokasyonuna aracılık edebilir.
Diğer fagositlerle karşılaştırıldığında, AM'deki solunum patlaması daha büyüktür. Oksijenden bağımsız mikrobisidal mekanizmalar asit üretimine, lizozimlerin salgılanmasına, demir bağlayıcı proteinlere ve toksik katyonik polipeptitlerin sentezine dayanır. Makrofajlar, granülleri ve lizozomları içinde paketlenmiş bir antimikrobiyal molekül repertuarına sahiptir. Bu organeller , proteazlar, nükleazlar, fosfatazlar, esterazlar, lipazlar ve yüksek düzeyde bazik peptitler gibi fagolizozoma salınan sayısız parçalayıcı enzim ve antimikrobiyal peptit içerir. Ayrıca, makrofajlar, temel mikro besinlerin fagosite edilmiş patojenlerini aç bırakmak için kullanılan bir dizi besin yoksunluğu mekanizmasına sahiptir. Bazı mikroorganizmalar, fagositler tarafından yok edilmekten kurtulmalarını sağlayan karşı önlemler geliştirmiştir. Lizozomal aracılı bozulma, bir enfeksiyonu nötralize etmek ve kolonizasyonu önlemek için etkili bir yol olmasına rağmen, birçok patojen makrofajları parazitleyerek büyüme, bakım ve replikasyon için bir konak hücre olarak kullanır. Toxoplasma gondii ve mikobakteriler gibi parazitler, fagozomların lizozomlarla kaynaşmasını önleyebilir, böylece lizozomal hidrolazların zararlı etkisinden kaçabilir. Diğerleri, gelişimlerinin engellenmediği sitozolik matrikse ulaşmak için fagositik vakuolden ayrılarak lizozomlardan kaçınır. Bu durumlarda, makrofajlar, bir dizi yüksek derecede toksik molekül üreterek ve onu aç bırakmak için yoksunluk mekanizmasını indükleyerek fagosite edilmiş mikroorganizmaları aktif olarak yok etmek için tetiklenebilir. Son olarak, bazı mikropların solunum patlaması sırasında oluşan oksijen metabolitlerini detoksifiye etmek için enzimleri vardır.
Alveolar makrofajlar, tehdidi savuşturmak için yetersiz olduklarında, adaptif immün yanıttan sorumlu oldukça gelişmiş bir savunma fagositik hücre ağı oluşturmak için proinflamatuar sitokinleri ve kemokinleri serbest bırakabilirler.
Akciğerler özellikle hassastır ve hasara eğilimlidir, bu nedenle tip 1 ve tip II pnömositlere ikincil hasarı önlemek için alveolar makrofajlar, fagositik ekspresyonun aşağı regüle edilmesiyle kanıtlandığı gibi, küçük inflamatuar sitokinler üreten ve az fagositik aktivite gösteren sessiz bir durumda tutulur. reseptör Makrofaj 1 antijeni (Mac-1). AM'ler, vücudun iki bağışıklık sisteminin indüklenmesini aktif olarak bastırır: adaptif bağışıklık ve hümoral bağışıklık. Uyarlanabilir bağışıklık, AM'nin interstisyel dendritik hücreler, B-hücreleri ve T-hücreleri üzerindeki etkileri yoluyla bastırılır, çünkü bu hücreler yok ettikleri şeyler konusunda daha az seçicidir ve genellikle normal hücrelere gereksiz hasara neden olur. Alveolar makrofajlar, alt solunum yollarında kontrolsüz inflamasyonu önlemek için nitrik oksit, prostaglandinler, interlökin-4 ve -10(IL-4, IL-10) ve dönüştürücü büyüme faktörü-β (TGF-β) salgılarlar.
Sinyal moleküllerinin rolü
Nitrik oksit
NO, kemirgenlerde başlıca bir immünomodülasyon kaynağıdır ve alveolar makrofajda enzim nitrik oksit sentetaz tip 2 (NOS2) tarafından üretilir. NO, ekspresyonu T hücresi proliferasyonu için temel olan interlökin-2 (IL-2) reseptörünün üretiminde yer alan kinazların tirozin fosforilasyonunu inhibe eder. Ancak insanlarda NOS2 aktivitesinin doğrulanması zor olmuştur.
İnsanda indüklenebilir nitrik oksit sentetaz (iNOS) promotörünün lipopolisakkaritler (LPS) + interferon gama (IFNy) tarafından NO aktivasyonuna yanıt vermemesinin iki açıklaması vardır . Birincisi, fare NOS2 geninin LPS/IFNy ile indüklenen ekspresyonunu düzenleyen güçlendirici elementin insan karşılığında çeşitli inaktive edici nükleotit varyasyonlarının olmasıdır. İkincisi, NOS2 geninin (LPS ile indüklenebilir nükleer faktör-kappa B/Rel kompleksi) optimum ifadesi için gerekli olan insan makrofajlarında nükleer bir faktörün bulunmamasıdır. NOS2'nin doğrulanmasındaki zorluğun, insan AM'lerinde kemirgen AM'lerine kıyasla çok daha sıkı kontrol edilen bir ifadeden kaynaklandığı varsayılmaktadır. NOS2, bir alerjen veya provokatörün inflamatuar sitokin üretimini uyardığı, bunun da NO üretimini uyardığı ve NO'nun sitokin üretimini aşağı regüle ettiği bir oto-düzenleyici geri besleme döngüsünün parçasıdır. Sıçanlarda NO, dendritik hücrelerin granülosit-makrofaj koloni uyarıcı faktör (GM-CSF) aracılı olgunlaşmasını inhibe eder ve insanlarda, döngüsel GMP'ye bağlı mekanizmalar yoluyla insan dendritik hücrelerinin TNF-alfa aracılı olgunlaşmasını engeller. NO, insan dendritik hücrelerinin iltihaplanma bölgelerinde antijenleri içselleştirme yeteneğini uzatır, bu nedenle antijene özgü bağışıklık tepkilerine yol açan başlangıç adımlarını modüle eder.
NO üretimi astım patolojisi ile ilgili olarak gösterilmiştir. Astımlı hastalar, hava yolu epitel hücrelerinde artmış bir iNOS ekspresyonu ve solunan havada artmış bir nitrik oksit seviyesi gösterir.
Prostaglandin endoperoksit 2 (PGE2)
En önemlileri prostaglandinler ve sitokinler olan diğer birçok immünomodülatör faktör izole edilmiştir. PGE2, makrofajlardan türetilen ve açıklanan ilk immünomodülatördü. PGE2, periferik kan lenfosit IL-10 transkripsiyonunu ve protein üretimini güçlendirmede işlev görür; makrofajları ve T-hücrelerini devre dışı bırakmada olduğu gibi. PGE2, hücre zarı bileşeni olan araşidonik asitten türetilen bir immünomodülatör eikosanoiddir ve araşidonik asit kademesinde işlenir: araşidonik asidin siklooksijenaz ve PGE2 sentaz enzimleri tarafından ardışık oksijenlenmesi ve izomerizasyonu . Hedef hücrelerin PGE2 tarafından düzenlenmesi, EP1, EP2, EP3 ve EP4 olarak adlandırılan dört hücre zarı ile ilişkili G-protein-bağlı E-prostanoid (EP) reseptörü aracılığıyla sinyalleme yoluyla gerçekleşir. PGE2, EP2 ve EP4 reseptör sinyalleri aracılığıyla hücre içi siklik adenosin monofosfat (cAMP) efektörlerinin üretimini uyarma yeteneği aracılığıyla Fcy aracılı fagositozu bozarak AM tarafından bakteriyel öldürmeyi ve ROI üretimini inhibe eder. EP2 ve EP4 reseptörleri, esas olarak uyarıcı G proteini (Gs), artan adenilil siklaz (AC) aktivitesi ve ardından cAMP oluşumu yoluyla sinyal verir. cAMP, iki akış aşağı efektör molekülün, protein kinaz A'nın (PKA) ve cAMP tarafından doğrudan aktive edilen değişim proteinlerinin (Epac-1 ve -2) aktivasyonu yoluyla çoklu hücresel fonksiyonları etkileyen ikinci bir habercidir. Epac-1 ve PKA, AM bakteri öldürmesinin inhibisyonunda rol oynayan önemli faktörlerdir. PKA'nın etkileri, birçok hücresel protein, özellikle transkripsiyon faktörü cAMP yanıt elemanı bağlayıcı protein (CREB) üzerindeki serin ve treonin kalıntılarını fosforile etme yeteneğinden kaynaklanır. cAMP/PKA/CREB ekseni, TNF-alfa salınımının inhibisyonuna aracılık eder. AM'ler tarafından fagosite edilmiş bakterilerin öldürülmesi, ROI'nin azaltılmış NADPH oksidaz aracılı salınımı gibi birkaç farklı mikrobisidal mekanizmaya bağlıdır. NADPH oksidaz tarafından ROI üretimi, FcR aracılı fagositozdan sonra önemli bir bakterisidal mekanizmadır. PGE2, ligasyon yoluyla hem Gs-bağlı EP2 hem de EP4 reseptörlerini aktive eder, cAMP üretimini uyarır ve ardından aşağı akış cAMP efektörleri, PKA ve Epac-1'in aktivasyonunu sağlar; her ikisi de NADPH oksidaz bileşeni p47phox'un fosforilasyonunu ve fagozomal membran translokasyonunu bozar, böylece solunum patlamasını inhibe eder.
İnterlökin-4 ve -10
IL-4, T yardımcı tip 2(Th2) hücrelerinin gelişiminde anahtar rol oynayan bir pleiotropik sitokindir. IL-4, saf CD4-T hücrelerinin olgun Th2 tipi hücrelere farklılaşması için önemlidir; ve ayrıca immün yanıtların gelişimi sırasında IgE ve IgG4'e geçiş yapan Immunoglobulin (Ig) sınıfı için. Ig, yalnızca memelilerde bulunan ve vücudu kompleman aktivasyonu, fagositoz için opsonizasyon ve toksinlerinin nötralizasyonu yoluyla koruyarak birçok patojen türüne karşı alerji yanıtında ve savunmada önemli bir rol oynayan bir antikor sınıfıdır.
IL-4 ve IL-10'un her ikisinin de insan AM'leri tarafından metaloproteinazların (kollajen ve diğer hücre dışı proteinleri parçalayan endopeptidazlar) üretimini azalttığı gösterilmiştir. IL-4'ün makrofaj biyolojik işlevi üzerinde uyarıcı veya engelleyici olabilen ikili etkileri vardır. MHC sınıf II antijenini (ekzojen yolun bir parçası olarak yalnızca CD4-T hücreleri ile etkileşime giren hücre dışı protein kompleksi) ve Mac-1 (doğuştan tamamlayıcı sistemin bir parçası olarak yüzey reseptörü) ekspresyonunu arttırır, böylece fagositozu teşvik eder. IL-4'ün ayrıca, PGE2 üretiminde kritik olan prostaglandin H sentaz -2 (PGHS-2) enziminin ekspresyonunu azaltarak PGE2 üretimini engellediği de gösterilmiştir. Bununla birlikte, IL-4, tümü proinflamatuar yanıtta önemli sitokinler olan TNF-alfa, IL-1 ve -6'nın üretimini inhibe eder).
IL-10, pro-inflamatuar sitokinler TNF-alfa ve INF-gama'nın salgılanmasını inhibe eder, böylece T-hücrelerinin, NK hücrelerinin ve AM'nin proliferasyonunu baskılar. IL-10, TGF-β ile benzer immünomodülatör mekanizmaları paylaşır. Her iki sitokinin de insan alveolar makrofajlarında apoptoz oranını azalttığı, dolayısıyla dolaylı olarak T hücresi proliferasyonunun alveolar makrofaj aracılı inhibisyonunu arttırdığı düşünülmektedir. Bakteriyel ürünler tarafından aktivasyon üzerine bazal apoptoz hızında önemli bir artış vardır. Apoptoz, özellikle sitokinlerin mevcudiyeti ile düzenlenir: IFNy, apoptoz oranını arttırırken, IL-10 ve TGF-β onu azaltır. Bununla birlikte, IL-10'un bağışıklık sistemi üzerinde ters etkileri vardır ve aslında yabancı patojenler tarafından enfeksiyonu teşvik ettiği gösterilmiştir. IL-10'un bakteri ve parazit enfeksiyonundaki rolü, konakçı bağışıklık sistemlerinden kaçmak için bir strateji olarak keşfedilmiştir. AM'leri zarlarından istila ederek parazitleştiren ve içlerinde büyüyerek ve çoğalarak, AM'leri konakçı hücreler olarak kullanarak gelişen bakteriler vardır. Normalde bu enfeksiyon, bakterileri yok eden alveolar makrofajlardaki enzimleri aktive eden T hücreleri tarafından elimine edilebilir; ancak bu bakterilerin sitokin sinyalleşme ağını kendi avantajlarına göre değiştirdiği gösterilmiştir. Bir inhibitör sitokin olarak IL-10, IFNy'nin hücre içi Legionella pneumophila replikasyonuna karşı koruyucu etkisini tamamen tersine çevirerek insan alveolar makrofajlarının ve monositlerinin enfeksiyonunu kolaylaştırır. Yersinia enterocolitica'nın ayrıca Toll benzeri reseptör-2 ve CD14 (TLR4 aracılı LPS sinyalinin yardımcı bir yüzey proteini) yoluyla IL-10'u indükleyen ve IFNy ve TNF-alfa'nın baskılanmasıyla sonuçlanan virülans antijeni LcrV'yi saldığı gösterilmiştir. Bastırma.
Dönüştürücü büyüme faktörü β (TGF-β)
Normal koşullarda, alveolar makrofajlar alveolar epitel hücrelerine sıkı sıkıya yapışır, böylece αvβ6 integrin ekspresyonunu indükler. İntegrinler, TGF-β'yı aktive eden alfa ve beta alt birimlerinden oluşan dimerik hücre yüzeyi reseptörleridir.< TGF-β, hücre büyümesi, apoptoz, hücre dışı matris sentezi, iltihaplanma ve bağışıklık gibi çeşitli biyolojik süreçleri modüle eden çok işlevli bir sitokindir. tepkiler. TGF-β, pro-inflamatuar sitokin üretimini baskılayarak anti-inflamatuar aktiviteyi sıkı bir şekilde düzenler, böylece T-lenfosit fonksiyonunu inhibe eder. İntegrinler avβ6 ve avβ8, hücre yüzeyine gizli TGF-P'yi sekestre eder, burada aktivasyon, homeostazın korunmasında çevresel strese verilen hücresel tepkilere sıkı bir şekilde bağlanabilir; integrinler ayrıca aktive edilmiş TGFβ'yi makrofajların yakınında lokalize eder. Normal olarak olgun TGFβ, N-terminal fragmanı olan latent bir kompleks olarak, aktivitesini inhibe eden gecikme ile ilişkili peptit (LAP) olarak salgılanır. Gizli kompleks, gizli TGF-β-bağlayıcı proteinlere bağlanarak hücre dışı matrise kovalent olarak bağlanır. TGF-β, akciğerdeki çeşitli mekanizmalar tarafından aktive edilir ve sonuçta LAP'nin proteolizini veya konformasyonel değişimini içerir. αvβ6 integrin, integrin için bir ligand bağlama bölgesi olarak hizmet eden ve TGF-β aktivasyon aparatının temel bir bileşeni olan TGF-21 LAP'ye bağlanarak TGF-β aktivasyonuna aracılık edebilir. Aktive edildiğinde, TGFβ makrofaj işlevselliğinin (sitokin üretimi ve fagositoz) baskılanmasına yol açar. Aktive edilmiş TGF-β'nin alveolar makrofajlar üzerinde eksprese edilen reseptörlerine bağlanması, reseptörle düzenlenen Küçük Annelerin Dekapentaplejik (R-SMAD) homologları 2 ve 3'e karşı fosforilasyonu dahil olmak üzere aşağı yönde bir sinyalleşme kaskadı indükler. Fosforillenmiş SMAD-2 ve -3 daha sonra heteromerik kompleksler oluşturur. ortak aracılı SMAD 4 (eş-SMAD-4) ile. Birleştirildiğinde, kompleksler, importins alfa/beta yardımıyla nükleer gözenek yoluyla çekirdeğe yer değiştirir. Çekirdeğe girdikten sonra, bu kompleksler birikir ve sonunda TGF-β hedef genlerinin ekspresyonunu düzenleyen bir transkripsiyon faktörleri olarak hareket eder. Böylece TGF-β sinyali, bir hücrenin yüzeyindeki reseptörlerden çekirdeğe doğrudan bir yol içerir.
aktivasyon
Toll benzeri reseptörler (TLR'ler), çeşitli bakteri proteinlerini tanıyabilen PRR'leri işaret ediyor . Bakteriler, konak savunma mekanizmalarından kaçmak için araçlar geliştirmiş olsalar da, TLR'ler aracılığıyla doğuştan gelen bağışıklık sisteminin hücreleri tarafından tanınan lipoglikanlar ve lipoproteinler gibi PAMP'leri eksprese ederler. PAMP'lerin TLR'lere bağlanması üzerine TLR, konakçı hücrede inflamatuar ve savunma tepkilerini tetikleyerek alveolar makrofajlarda aktin polimerizasyonunu indükler (endositoz ve hareketlilikte çok önemli bir bileşen). Alveolar makrofajlarda aktin polimerizasyonu integrin ekspresyonunun baskılanmasına neden olur, bu da TGF-β'nin deaktivasyonuna ve SMAD 2/3'ün bazal fosforilasyon seviyesinin aşağı regülasyonuna neden olur; daha sonra alveolar makrofajların aktivasyonuna ve alveolar epitel hücrelerinden ayrılmasına yol açar [15]. Aktivasyon üzerine, makrofajlar fagositoz için hazırlanır ve proinflamatuar sitokinleri (TNF-α ve IL-6) salgılamaya başlar.
Makrofajların hazırlanması, IFN-y ve TNF-a tarafından solunum patlama aktivitesinin arttırılmasını içerir. IFNy, makrofajlarda NADPH için NADPH oksidazın artan afinitesinin yanı sıra, gp91phox proteini için artan bir gen transkripsiyon hızı ve mesaj ekspresyonuna neden olur. TNF-α, hem p47phox hem de p67phox transkriptlerinin ekspresyonunu artırarak bir otokrin uyarıcı görevi görür. Solunum patlaması yanıtı sırasında üretilen ROI'ler, sırayla, makrofajlar tarafından TNF-a üretimini arttırır.
devre dışı bırakma
Kollateral hasarı önlemek için gaz değişimi mümkün olduğu kadar çabuk eski haline getirilmelidir, bu nedenle aktive lenfositler makrofajlar tarafından matris metalloproteinaz MMP-9 üretimini uyarmak için IFNy salgılar. AM'lerin, kısmen fagositozun inhibisyonunda yer alan yollar olan PGE2'ye bağlı PKA sinyal yolları aracılığıyla MMP-9 ürettiği bildirilmiştir. MMP-9, latent TGF-β'yi aktive ederek alveolar epitel hücreleri üzerinde αvβ6 integrinlerinin ekspresyonunu yeniden indükler, böylece alveolar makrofajı dinlenme durumuna döndürür. TGF-β'nın aktivasyonu da avantajlıdır çünkü üretimi, alveolar duvar mimarisini restore etmek için gerekli olan interstisyel fibroblastlarda kollajen sentezini uyarır.
Ayrıca bakınız
Referanslar
Dış bağlantılar
- Histoloji görüntüsü: 13906loa – Boston Üniversitesi'nde Histoloji Öğrenme Sistemi - "Solunum Sistemi: akciğer (insan), alveolar makrofajlar"
- KUMC resp-resp16 "Alveoli" de histoloji
- ufl.edu'da kaydırın
