Nakil reddi - Transplant rejection
| nakil reddi | |
|---|---|
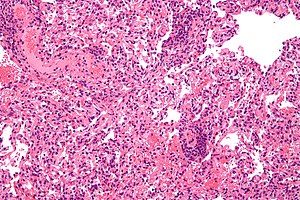 | |
| Akciğer nakli reddini gösteren mikrograf . Akciğer biyopsisi . H&E lekesi . | |
| uzmanlık | immünoloji |
| Tedavi | immünosupresif ilaçlar |
Transplant reddi , nakledilen doku, nakledilen dokuyu yok eden alıcının bağışıklık sistemi tarafından reddedildiğinde meydana gelir . Transplant reddi, donör ve alıcı arasındaki moleküler benzerlik belirlenerek ve transplant sonrası immünosupresan ilaçların kullanılmasıyla azaltılabilir .
Pretransplant reddi önleme
1954 yılında Joseph Murray tarafından gerçekleştirilen ilk başarılı organ nakli tek yumurta ikizlerini içeriyordu ve bu nedenle herhangi bir organ reddi gözlenmedi. Aksi takdirde, uyumsuz gen varyantlarının sayısı, yani majör histo-uyumluluk kompleksi (MHC), sınıf I ve II olarak adlandırılan hücre yüzeyi moleküllerini kodlayan aleller , transplant reddinin hızı ve ciddiyeti ile ilişkilidir. İnsanlarda MHC, insan lökosit antijeni (HLA) olarak da adlandırılır .
Sitotoksik çapraz eşleştirme testi, hücresel bağışıklığın aracılık ettiği reddi öngörebilse de, nakledilecek organ tipine özgü genetik ekspresyon testleri, örneğin AlloMap Moleküler Ekspresyon Testi , yüksek bir negatif tahmin değerine sahiptir. Yalnızca ABO uyumlu greftlerin (donör ve alıcı arasındaki eşleşen kan gruplarının) nakledilmesi, hümoral bağışıklığın aracılık ettiği reddi önlemeye yardımcı olur .
ABO-uyumsuz nakiller
Çok küçük çocuklar (genellikle 12 aylıktan küçük, ancak genellikle 24 aylıktan büyük) iyi gelişmiş bir bağışıklık sistemine sahip olmadıklarından, uyumsuz donörlerden organ almaları mümkündür. Bu, ABO-uyumsuz (ABOi) transplantasyon olarak bilinir. ABOi ve ABO uyumlu (ABOc) alıcılar arasında greft sağkalımı ve hasta mortalitesi yaklaşık olarak aynıdır. Bebek kalp nakillerine odaklanılmış olsa da, ilkeler genellikle katı organ naklinin diğer biçimleri için geçerlidir.
En önemli faktörler, alıcının izohemaglutinin üretmemesi ve düşük seviyelerde T hücresinden bağımsız antijenlere sahip olmasıdır . UNOS düzenlemeleri, izohemaglutinin titreleri 1:4 veya altındaysa ve eşleşen bir ABOc alıcısı yoksa, iki yaşın altındaki çocuklarda ABOi transplantasyonuna izin verir. Çalışmalar, bir alıcının ABOi transplantasyonuna maruz kalabileceği sürenin, kendi kendine olmayan A ve B antijenlerine maruz kalmasıyla uzayabileceğini göstermiştir. Ayrıca, alıcı (örneğin, tip AB pozitif greftli B tipi pozitif) nihai yeniden transplantasyona ihtiyaç duyarsa, alıcı her iki kan türünden yeni bir organ alabilir.
Yetişkinlerde ABO-uyumsuz kalp nakillerinde sınırlı başarı elde edilmiştir, ancak bu, yetişkin alıcıların düşük seviyelerde anti-A veya anti-B antikorlarına sahip olmasını gerektirir. Böbrek nakli, ABoc nakillerine benzer uzun vadeli greft sağkalım oranları ile daha başarılıdır.
İmmünolojik reddetme mekanizmaları
Reddetme, hücresel bağışıklık (hedef hücrelerin apoptozunu indükleyen öldürücü T hücrelerinin aracılık ettiği) ve ayrıca hümoral bağışıklık ( antikor moleküllerini salgılayan aktif B hücrelerinin aracılık ettiği ) yoluyla adaptif bir bağışıklık tepkisidir , ancak eyleme doğuştan gelen bağışıklık tepkisinin bileşenleri ( fagositler) tarafından birleştirilir. ve çözünür bağışıklık proteinleri). Farklı nakledilen doku türleri, farklı reddetme mekanizmaları dengelerini destekleme eğilimindedir.
bağışıklama
Bir hayvanın aynı veya benzer türün farklı bir üyesinin antijenlerine maruz kalması allostimülasyondur ve doku allojeniktir . Nakledilen organlar genellikle dokuları zaten iskemi veya inflamasyonu sürdüren bir kadavradan (genellikle travmaya yenik düşen bir konakçıdan) alınır .
Donör dokusunun birincil antijen sunan hücreleri (APC'ler) olan dendritik hücreler (DC'ler), alıcının periferik lenfoid dokusuna ( lenfoid foliküller ve lenf düğümleri ) göç eder ve donörün kendi peptitlerini alıcının lenfositlerine (bağışıklık hücreleri) sunar. lenfoid dokularda bulunur). Lenfositler, adaptif bağışıklığı etkinleştiren iki sınıf içerir ve buna spesifik bağışıklık da denir. Yardımcı T hücreleri ve öldürücü T hücreleri alt sınıfları dahil olmak üzere spesifik bağışıklık T hücrelerinin lenfositleri ve B hücreleri .
Alıcının yardımcı T hücreleri, donörün kendi peptitlerine veya donörün Majör doku uyumluluk kompleks moleküllerine veya her ikisine yönelik spesifik bağışıklığı koordine eder .
bağışıklık hafızası
Bellek yardımcı T hücrelerinin CD4 reseptörleri , aşı dokusunun hedef hücrelerinin yüzeylerinde eksprese edilen MHC sınıf II moleküllerine bağlandığında , bellek yardımcı T hücrelerinin T hücre reseptörleri (TCR'ler) sunulan hedef antijenlerini tanıyabilir. MHC sınıf II molekülleri tarafından. Bellek yardımcı T hücresi daha sonra, efektör hücreler olarak, bağışıklık sinyal moleküllerini ( sitokinler ) yaklaşık olarak sitokin dengesinde salgılayan klonlar üretir; bu, bellek yardımcı T hücresinin antijeni ezberlemeye hazır hale gelmesinde hakim olmuştur. Bu örnekteki hazırlama olayı, iltihaplanma sırasında meydana geldiğinden, bağışıklık belleği pro-inflamatuardır.
hücresel bağışıklık
Transplant reddi, transplant alıcısının T hücrelerinin alloreaktif hale geldiği, bağışlanan organdaki majör histo-uyumluluk kompleksi (MHC) antijenlerini tanıdığı ve bunlara karşı savunmak için lokal immün ve inflamatuar yanıtları teşvik ettiği T hücrelerinin aracılık ettiği bir Tip IV (“gecikmeli”) aşırı duyarlılık reaksiyonudur. algılanan tehdit. T hücreleri, bağışlanan organın MHC antijenlerini iki yoldan biriyle tanıyabilir: nakledilen organın antijen sunan hücrelerinin (MHC sınıf I molekülleri içeren dendritik hücreler gibi) alıcının lenf düğümlerine göç ettiği ve T hücrelerini aktive ettiği doğrudan bir yol orada ikamet eden; veya alıcının dendritik hücrelerinin, donör MHC proteinleri gibi donör proteinlerini endositoz edebildiği ve sekonder lenfoid dokulardaki T hücrelerini aktive edebildiği dolaylı bir yol. Sitotoksik T lenfositler (CTL'ler) olarak da adlandırılan alloreaktif öldürücü T hücreleri, nakledilen dokunun MHC sınıf I moleküllerine bağlanan ve donörün kendi peptitlerini gösteren CD8 reseptörlerine sahiptir. (Canlı donörde, kendi kendine antijenlerin bu şekilde sunumu, kendi kendine toleransın korunmasına yardımcı oldu.) Bunun üzerine, öldürücü T hücrelerinin T hücresi reseptörleri (TCR'ler), eşleşen epitoplarını tanır ve hedef hücrenin apoptoz yoluyla programlanmış hücre ölümünü tetikler.
hümoral bağışıklık
Kendinden olmayan antijene spesifik bağışıklığı hazırlayan daha önceki bir birincil maruziyet yoluyla geliştirilen bir nakil alıcısı, nakil olayı üzerine donör dokusuyla çapraz reaksiyona giren spesifik antikora sahip olabilir, ikincil bir maruziyet . Bu, hamilelik sırasında allojenik kan transfüzyonu veya travmayı takiben küçük kan grubu maruziyeti (örn. Kell) için tipiktir. İkincil maruziyette, bu çapraz reaktif antikor molekülleri , nakledilen dokuyu alevlendiren ve yok eden, tamamlayıcı olarak adlandırılan çözünebilir bağışıklık proteinleri ve fagositler olarak adlandırılan doğuştan gelen bağışıklık hücreleri olan doğuştan gelen bağışıklık ile etkileşime girer .
Antikor
Aktive edilmiş bir B hücresi tarafından salgılanan, daha sonra plazma hücresi olarak adlandırılan bir antikor molekülü, temel birimi Y harfi şeklinde olan çözünür bir immünoglobulindir (Ig) : iki kol Fab bölgeleridir , tek sap ise Fc bölgesidir . Fab bölgesinin iki uç her bir paratopu tamamen adı verilen bir uygun moleküler dizisini ve 3 boyutlu biçim (konformasyon) bağlar, epitop , hedef antijen içindeki.
Opsonizasyon
IgG'nin Fc bölgesi ayrıca, kandaki nötrofiller ve dokulardaki makrofajlar gibi fagosit üzerindeki Fc reseptörünün , antikor molekülünün FC sapına bağlandığı bir süreç olan bir fagosit tarafından opsonizasyonu mümkün kılar ve fagosit, bağlı antijenin artmış alımını sergiler. antikor molekülünün Fab bölgesine.
tamamlayıcı kaskad
Ig sınıfı gama (IgG) paratopu , eşleşen epitopuna bağlandığında, IgG'nin Fc bölgesi konformasyonel olarak kayar ve bir hücre zarında bir delik açarak sona eren tamamlayıcı kaskadı başlatan bir tamamlayıcı proteini barındırabilir . Bu kadar çok delik açılmışken, sıvı hücreye hücum eder ve hücreyi parçalar.
Hücre kalıntıları, fagositlerin zarları üzerindeki Toll benzeri reseptörler (TLR'ler) gibi patern tanıma reseptörleri (PRR'ler ) tarafından hasarla ilişkili moleküler paternler (DAMP'ler) olarak tanınabilir ve bunun üzerine proinflamatuar sitokinler salgılar ve bölgeye trafik için daha fazla fagosit toplar. salgılanan sitokinlerin konsantrasyon gradyanını algılayarak ( kemotaksis ).
| Doku | mekanizma |
|---|---|
| Kan | Antikorlar (izohemagglutininler) |
| Böbrek | Antikorlar, hücre aracılı bağışıklık (CMI) |
| Kalp | Antikorlar, CMI |
| Deri | CMI |
| Kemik iliği | CMI |
| Kornea | Vaskülarize olmadıkça genellikle kabul edilir: CMI |
Tıbbi kategoriler
hiperakut ret
Önceden var olan başlattığı humoral bağışıklığı , hiperakut ret naklinden sonra birkaç dakika içinde tezahür eder ve doku implante bırakılırsa getiren sistemik inflamatuar yanıt sendromu . Böbrek naklinde yüksek risk , bir antikor molekülü aynı anda birden fazla hedef hücreye bağlandığından , kırmızı kan hücrelerinin (RBC'ler veya eritrositler) hızlı kümelenmesi, yani aglütinasyonudur .
Böbrekler, insan donörlerinden rutin olarak elde edilebilirken, çoğu organ, diğer türlerden ksenotransplantların değerlendirilmesine yol açacak şekilde yetersizdir. Domuzlar, insanlarla paylaştıkları anatomik ve fizyolojik özellikler nedeniyle seçilen ksenotransplantlar için özellikle olası kaynaklardır. Bununla birlikte, şeker galaktoz-alfa-1,3-galaktoz (aGal) içerisinde hiperakut ret önemli bir faktör olarak dahil edilmiştir ksenonaklinin . Neredeyse tüm diğer memelilerin aksine, insanlar ve diğer primatlar αGal yapmazlar ve aslında onu bir antijen olarak tanırlar. Transplantasyon sırasında, ksenoreaktif doğal antikorlar, greft endotelindeki αGal'i bir antijen olarak tanır ve sonuçta ortaya çıkan kompleman aracılı immün yanıt, transplantın reddedilmesine yol açar.
Akut reddetme
Oluşumu ile geliştirilmesi hücresel bağışıklık , akut ret immünosupresyon (genellikle ilaç yoluyla) elde edilir sürece, aynı İkizler arasında hariç, tüm transplantlarında bir dereceye kadar cereyan etmektedir. Akut ret, nakilden bir hafta sonra başlar, aylar veya yıllar sonra ortaya çıkabilmesine rağmen, risk ilk üç ayda en yüksek seviyededir. Böbrek veya karaciğer gibi yüksek derecede vasküler dokular genellikle en erken belirtileri – özellikle kan damarlarını kaplayan endotel hücrelerinde – barındırır, ancak sonuçta karaciğer transplantlarının kabaca %10 ila %30'unda ve böbrek transplantlarının %10 ila %20'sinde ortaya çıkar. Tek bir akut rejeksiyon epizodu tanınabilir ve derhal tedavi edilebilir, bu genellikle organ yetmezliğini önler, ancak tekrarlayan epizodlar kronik rejeksiyona yol açar . Akut rejeksiyon sürecinin, hücre aracılı yolun, özellikle mononükleer makrofajlar ve T-lenfositlerin aracılık ettiğine inanılmaktadır. Akut reddin histolojisi, yoğun lenfositik hücresel infiltrat ve ayrıca organ donör damarlarının vasküliti ile tanımlanır.
Kronik reddetme
Kronik rejeksiyon terimi, başlangıçta , nakledilen dokunun kan damarlarının fibrozu yoluyla nakledilen organlarda uzun vadeli işlev kaybını tanımladı . Bu artık kronik allogreft vaskülopatisidir , ancak bağışıklığın daha belirgin yönleri nedeniyle reddetmeye atıfta bulunan kronik reddi bırakır .
Kronik rejeksiyon, akciğer nakli yapılan çoğu alıcıda uzun vadeli morbiditeyi açıklar, medyan sağkalım kabaca 4,7 yıl, diğer büyük organ nakillerine kıyasla sürenin yaklaşık yarısı. Histopatolojide durum, klinik olarak progresif hava akımı obstrüksiyonu olarak ortaya çıkan, sıklıkla nefes darlığı ve öksürüğü içeren bronşiolit obliteranstır ve hasta sonunda pulmoner yetmezliğe veya sekonder akut enfeksiyona yenik düşer .
Başka bir neden için hava akımı tıkanıklığı değildir atfedilebilen etiketlenir bronşiyolit obliterans sendromu kalıcı bir düşüş üç hafta veya daha fazla in tarafından doğrulanmıştır (BOS) zorlamalı ekspiratuar hacim (FEV 1 , en az% 20). BOS, akciğer nakli alıcılarının %50'sinden fazlasında 5 yıl içinde ve %80'inden fazlasında on yıl içinde görülür. İlk olarak lenfositlerin infiltrasyonu , ardından epitel hücre hasarı, ardından inflamatuar lezyonlar ve skar dokusu oluşturan proteinleri çoğaltan ve salgılayan fibroblastların ve miyofibroblastların toplanmasıdır . Genel olarak tahmin edilemez olduğu düşünülen BOS progresyonu büyük ölçüde değişir: akciğer fonksiyonu aniden düşebilir ancak yıllarca stabilize olabilir veya birkaç ay içinde hızla ölüme ilerleyebilir. Risk faktörleri arasında önceki akut rejeksiyon epizodları, gastroözofageal reflü hastalığı , akut enfeksiyonlar, belirli yaş grupları, HLA uyumsuzluğu , lenfositik bronşiyolit ve greft disfonksiyonu (örneğin, hava yolu iskemisi) yer alır.
Uyumsuzluk nedeniyle reddedilme
Transplant reddinin başlıca nedenlerinden biri, reçete edilen immünosupresan rejimlere uyulmamasıdır. Bu, özellikle ergen alıcılar için geçerlidir ve bazı durumlarda uyumsuzluk oranları %50'ye yakındır.
Reddetme algılama
Akut ret teşhisi klinik verilere (hasta belirti ve semptomlarına) dayanır, ancak aynı zamanda kan ve hatta doku biyopsisi gibi laboratuvar verilerini de gerektirir . Laboratuvar patoloğu genellikle üç ana histolojik işaret arar : (1) özellikle belirgin oranlarda infiltre eozinofiller , plazma hücreleri ve nötrofillerin eşlik ettiği infiltre T hücreleri , (2) transplante edilen doku tipine göre değişen doku anatomisinde yapısal uyumsuzluk ve (3) kan damarlarında yaralanma. Ancak doku biyopsisi, örnekleme sınırlamaları ve invaziv prosedürün riskleri/komplikasyonları nedeniyle kısıtlanır. Hücresel manyetik rezonans görüntüleme bağışıklık hücrelerinin (MRG) radyoaktif vivo kudreti-Benzer için gen ifadesi profillerinin (GEP) -TEKLİF invazif olmayan test.
reddetme tedavisi
Hiperakut rejeksiyon ciddi şekilde ve dakikalar içinde ortaya çıkar ve bu nedenle tedavi hemen yapılır: dokunun çıkarılması. Kronik rejeksiyon genellikle geri döndürülemez ve tedaviye zayıf olarak kabul edilir - yalnızca yeniden transplantasyon genellikle mümkünse endikedir - ancak akciğer transplantlarının kronik reddini geciktirmek veya önlemek için inhale siklosporin araştırılmaktadır. Akut ret , birkaç stratejiden biri veya birkaçı ile tedavi edilir. Tedaviye rağmen, reddedilme, transplant başarısızlığının önemli bir nedeni olmaya devam etmektedir.
immünosupresif tedavi
Kısa süreli yüksek doz kortikosteroidler uygulanabilir ve tekrarlanabilir. Üçlü tedavi, bir kalsinörin inhibitörü ve bir anti-proliferatif ajan ekler . Kalsinörin inhibitörleri veya steroidlerin kontrendike olduğu durumlarda mTOR inhibitörleri kullanılır.
İmmünosupresif ilaçlar :
- kortikosteroidler
- kalsinörin inhibitörleri
- Anti-proliferatifler
- mTOR inhibitörleri
Antikor bazlı tedaviler
Seçilmiş bağışıklık bileşenlerine özgü antikor, bağışıklık bastırıcı tedaviye eklenebilir. Monoklonal anti-T hücresi antikoru OKT3 yaygın ağır getirse de, bir kez reddini önlemek için kullanılan ve yine de zaman zaman şiddetli akut reddinin tedavisinde kullanılan, artık gözden düşmüştür sitokin salım sendromu ve geç post-transplant lenfoproliferatif bozukluğun . (OKT3, Birleşik Krallık'ta yalnızca adlandırılmış hasta kullanımı için mevcuttur.)
Antikor ilaçları :
- Monoklonal anti-IL-2Ra reseptör antikorları
- Monoklonal anti-IL-6R reseptör antikorları
- Poliklonal anti-T hücre antikorları
- Anti-timosit globulin (ATG)
- Anti-lenfosit globulin (ALG)
- Monoklonal anti-CD20 antikorları
Kan transferi
İmmünosupresif veya antikor tedavisine dirençli vakalar bazen, nakledilen dokuya özgü antikor moleküllerini uzaklaştırmak için fotoferez veya ekstrakorporeal fotoimmün tedavi (ECP) ile tedavi edilir.
ilik nakli
Kemik iliği nakli , nakil alıcısının bağışıklık sistemini donörünkiyle değiştirebilir ve alıcı yeni organı reddetmeden kabul eder. Kemik iliğinin hematopoietik kök hücreleri ( bağışıklık sistemini oluşturan beyaz kan hücreleri de dahil olmak üzere bitkin kan hücrelerini yenileyen kök hücrelerin rezervuarı) organı bağışlayan kişiye veya tek yumurta ikizine veya bir klona ait olmalıdır . Bununla birlikte, kemik iliği ile giren olgun lenfositlerin yeni konak dokuları yabancı olarak tanıması ve onları yok etmesi nedeniyle graft-versus-host hastalığı (GVHD) riski vardır .
Gen tedavisi
Gen tedavisi kullanılabilecek başka bir yöntemdir. Bu yöntemde vücudun nakilleri reddetmesine neden olan genler devre dışı bırakılır. Araştırma halen yürütülmektedir ve bugüne kadar hastaları tedavi etmek için hiçbir gen tedavisi kullanılmamaktadır. Mevcut araştırmalar, CD4 ve CD8 T hücreleri aracılığıyla allogreft reddine aracılık eden Th1 ve Th17'ye odaklanma eğilimindedir .
Ayrıca bakınız
Referanslar
Dış bağlantılar
| sınıflandırma | |
|---|---|
| Dış kaynaklar |
