Patiromer - Patiromer
 | |
| Klinik veriler | |
|---|---|
| Ticari isimler | Veltassa |
| Diğer isimler | RLY5016 |
| AHFS / Drugs.com | Monografi |
| MedlinePlus | a616012 |
| Lisans verileri | |
| Gebelik kategorisi |
|
Yönetim yolları |
Ağız yoluyla ( süspansiyon ) |
| ATC kodu | |
| Hukuki durum | |
| Hukuki durum | |
| Farmakokinetik veriler | |
| Biyoyararlanım | Absorbe edilmedi |
| Metabolizma | Yok |
| Etki başlangıcı | 7 sa. |
| Hareket süresi | 24 saat |
| Boşaltım | Dışkı |
| Tanımlayıcılar | |
| CAS numarası | |
| PubChem SID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Kimyasal ve fiziksel veriler | |
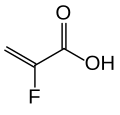
| Formül | [(C 3 H 3 FO 2 ) 182 · (C 10 H 10 ) 8 · (C 8 H 14 ) 10 ] n [Ca 91 (C 3 H 2 FO 2 ) 182 · (C 10 H 10 ) 8 · ( C 8 H 14 ) 10 ] n (kalsiyum tuzu) |
Veltassa markası altında satılan patiromer , yüksek kan potasyumunu tedavi etmek için kullanılan bir ilaçtır . Ağızdan alınır.
Yaygın yan etkiler arasında kabızlık , düşük kan magnezyum ve karın ağrısı bulunur. Bağırsaktaki potasyumu bağlayarak çalışır . 2015 yılında Amerika Birleşik Devletleri'nde tıbbi kullanım için onaylandı.
Tıbbi kullanımlar
Patiromer, hiperkaleminin tedavisi için kullanılır, ancak nispeten yavaş hareket ettiği için yaşamı tehdit eden hiperkalemi için acil bir tedavi olarak kullanılmaz. Böyle bir durum , örneğin kalsiyum infüzyonları, insülin artı glikoz infüzyonları, salbutamol inhalasyonu ve hemodiyaliz gibi başka tedavi türlerine ihtiyaç duyar .
Hiperkaleminin tipik nedenleri, kronik böbrek hastalığı ve renin-anjiyotensin-aldosteron sistemini (RAAS) inhibe eden ilaçların - örneğin ACE inhibitörleri , anjiyotensin II reseptör antagonistleri veya potasyum koruyucu diüretikler - veya genel olarak böbrek fonksiyonuna müdahale eden ilaçların uygulanmasıdır. olarak steroidal olmayan anti-enflamatuar ilaçlar (NSAID'ler).
Yan etkiler
Patiromer, çalışmalarda genellikle iyi tolere edildi. Klinik araştırmalara dahil edilen hastaların% 2'sinden fazlasında meydana gelen yan etkiler başlıca kabızlık, ishal, bulantı ve şişkinlik gibi mide-bağırsak sorunları ve ayrıca hastaların% 5'inde hipomagnezemi ( kanda düşük magnezyum seviyeleri ) idi. çünkü patiromer bağırsaktaki magnezyumu da bağlar.
Etkileşimler
Patiromer, 28 ilaçla ilaç-ilaç etkileşimleri açısından test edildi ve bu ilaçların 14'ü ile bağlanma veya etkileşim gösterdi. Bu, kullanılabilirliklerini ve dolayısıyla etkililiklerini azaltabilir; bu nedenle patiromer, ABD Gıda ve İlaç Dairesi (FDA) tarafından hastalara patiromer ve diğer oral ilaçlar arasında en az altı saat beklemelerini söyleyen kutulu bir uyarı almıştır .
In vitro etkileşim gösteren 14 ilaçtan 12'si, in vitro görülen sonuçların insanlarda bir etkiye dönüşüp dönüşmediğini değerlendirmek için sağlıklı gönüllülerde yapılan 1. faz çalışmalarında ileri testler için seçildi. Bu çalışmalar, patiromerin birlikte uygulandığında 12 ilacın dokuzunun emilimini değiştirmediğini gösterdi. Patiromer, birlikte uygulandığında üç ilacın emilimini azalttı, ancak patiromer ve bu üç ilaç 3 saat arayla alındığında etkileşim olmadı.
Bu bilgiler, FDA'ya ek bir Yeni İlaç Uygulaması (sNDA) şeklinde sunuldu ve sonuç olarak, Kasım 2016'da FDA , patiromer ve diğer oral ilaçların ayrılmasına ilişkin kutulu uyarının kaldırılmasını onayladı . Güncellenen etiket, hastaların patiromeri diğer oral ilaçlardan en az üç saat önce veya üç saat sonra almasını önermektedir.
Farmakoloji
Hareket mekanizması
Patiromer, gastrointestinal sistemdeki serbest potasyum iyonlarını bağlayarak ve değişim için kalsiyum iyonlarını serbest bırakarak çalışır, böylece kan dolaşımına emilim için mevcut potasyum miktarını düşürür ve dışkı yoluyla atılan miktarı arttırır . Net etki, kan serumundaki potasyum seviyelerinin azalmasıdır .
Potasyum seviyelerinin düşmesi, uygulamadan 7 saat sonra tespit edilebilir. Tedaviye devam edilirse seviyeler en az 48 saat düşmeye devam eder ve son dozun uygulanmasından sonra 24 saat stabil kalır. Bundan sonra potasyum seviyeleri en az dört günlük bir süre içinde tekrar yükselmeye başlar.
Farmakokinetik
Patiromer bağırsaktan emilmez, metabolize edilmez ve dışkı ile değişmeden atılır.
Kimya
Madde, divinilbenzenler ve 1,7- oktadien ile 2-floro akrilik asidin çapraz bağlı bir polimeridir . Bu kendi biçiminde kullanılan kalsiyum ile: tuzuna (1 oranı 2) sorbitol , bir kombinasyon olarak adlandırılır (iki kalsiyum iyonu veya dört flüoro akrilik asit birimi başına bir molekül) patiromer sorbitex kalsiyum .
Patiromer sorbitex kalsiyum, kirli beyaz ila açık kahverengi, amorf, serbest akışlı bir tozdur. Suda, 0.1 M hidroklorik asit , heptan ve metanolde çözünmez .
Tarih
Çalışmalar
RAAS inhibitörü tedavisi altında hiperkalemili 237 hastayı içeren Faz III çok merkezli bir klinik çalışmada, katılımcıların% 76'sı dört hafta içinde normal serum potasyum seviyelerine ulaştı. 107 yanıt vericinin sürekli patiromer tedavisi alan bir gruba ve bir plasebo grubuna randomize edilmesinden sonra , hiperkaleminin yeniden oluşumu sırasıyla% 15'e karşı% 60'tı .
Toplum ve kültür
Hukuki durum
ABD FDA, Ekim 2015'te patiromeri onayladı. Temmuz 2017'de Avrupa Birliği'nde kullanım için onaylandı.
Ayrıca bakınız
- Sodyum zirkonyum siklosilikat , başka bir potasyum bağlayıcı
Referanslar
Dış bağlantılar
- "Patiromer" . İlaç Bilgi Portalı . ABD Ulusal Tıp Kütüphanesi.
- "Patiromer sorbitex kalsiyum" . İlaç Bilgi Portalı . ABD Ulusal Tıp Kütüphanesi.