İnsan betaherpes virüsü 5 -Human betaherpesvirus 5
| İnsan sitomegalovirüsü | |
|---|---|
| uzmanlık | Bulaşıcı hastalık |
| nedenler | İnsan betaherpes virüsü 5 |
| İnsan betaherpes virüsü 5 | |
|---|---|

|
|
| Bir insan akciğer pnömositinin CMV enfeksiyonu | |
|
Virüs sınıflandırması |
|
| (rütbesiz): | Virüs |
| Bölge : | Duplodnaviria |
| Krallık: | heunggongvirae |
| filum: | peploviricota |
| Sınıf: | Herviviricetes |
| Emir: | herpes virüsü |
| Aile: | herpes virüsü |
| cins: | Sitomegalovirüs |
| Türler: |
İnsan betaherpes virüsü 5
|
| Eş anlamlı | |
|
|
İnsan sitomegalovirüsü ( HCMV ) olarakda adlandırılan insan betaherpesvirüsü 5 ,sırasıyla Herpesviridae veya herpesvirüslerolarak bilinen viral ailenin bir üyesi olan Cytomegalovirus cinsindeki virüs türüdür. Aynı zamanda yaygın olarak CMV olarak da adlandırılır. Herpesviridae içindeHCMV, diğer memelilerden sitomegalovirüsleri de içeren Betaherpesvirinae alt ailesineaittir. CMV, çift sarmallı bir DNA virüsüdür .
Vücudun her yerinde bulunabilmelerine rağmen, HCMV enfeksiyonları sıklıkla tükürük bezleri ile ilişkilidir . HCMV enfeksiyonu tipik olarak sağlıklı insanlarda fark edilmez, ancak HIV ile enfekte kişiler, organ nakli alıcıları veya yeni doğan bebekler gibi bağışıklığı baskılanmış kişiler için yaşamı tehdit edici olabilir . Konjenital sitomegalovirüs enfeksiyonu önemli morbiditeye ve hatta ölüme neden olabilir. Enfeksiyondan sonra, HCMV yaşam boyunca vücutta gizli kalır ve herhangi bir zamanda yeniden etkinleştirilebilir. Sonunda, mukoepidermoid karsinom ve muhtemelen prostat kanseri ve meme kanseri gibi diğer malignitelere neden olabilir .
HCMV tüm coğrafi bölgelerde ve tüm sosyoekonomik gruplarda bulunur ve gelişmiş ülkelerde yetişkinlerin %60 ila %70'ini ve gelişmekte olan ülkelerde ise neredeyse %100'ünü enfekte eder . Tüm herpes virüsleri arasında, HCMV, doğuştan gelen ve adaptif konak bağışıklığını değiştirmeye (kaçınmaya) adanmış en fazla geni barındırır ve yaşam boyu antijenik T hücre sürveyansı ve immün disfonksiyon yükünü temsil eder. Genellikle , genel popülasyonda antikorların varlığı ile gösterilir . Seroprevalans yaşa bağlıdır: 6 yaş ve üzeri bireylerin %58,9'u CMV ile enfekte olurken, 80 yaş ve üzeri kişilerin %90.8'i HCMV için pozitiftir. HCMV aynı zamanda gelişmekte olan bir fetüse en sık bulaşan virüstür . HCMV enfeksiyonu gelişmekte olan ülkelerde ve düşük sosyoekonomik statüye sahip topluluklarda daha yaygındır ve sanayileşmiş ülkelerde doğum kusurlarının en önemli viral nedenini temsil eder . Konjenital HCMV, çocuklarda sağırlık , öğrenme güçlüğü ve zihinsel engelliliğin önde gelen bulaşıcı nedenidir . CMV ayrıca "daha sonraki yaşamda bağışıklık parametreleri üzerinde büyük bir etkiye sahip gibi görünüyor ve artan morbidite ve nihai mortaliteye katkıda bulunabilir ."
Belirti ve bulgular
İnsan betaherpes virüsü 5 enfeksiyonunun klasik bir üçlü semptomu vardır: ateş , öğleden sonra veya akşamın erken saatlerinde zirveye ulaşır ; farenjit , genellikle eksüdatif; ve simetrik adenopati .
Viroloji
Aktarma
HCMV'nin kişiden kişiye bulaşma şekli bilinmemekle birlikte, tükürük , idrar , kan ve gözyaşı gibi vücut sıvıları yoluyla meydana geldiği tahmin edilmektedir . Sitomegalovirüs en çok öpüşme ve cinsel ilişki yoluyla bulaşır. Ayrıca enfekte bir anneden doğmamış çocuğuna da aktarılabilir. Enfeksiyon, virüsü tükürük , idrar veya diğer vücut sıvılarında salgılayan bir kişiyle yakın ve yakın temas gerektirir . CMV cinsel yolla ve anne sütü yoluyla bulaşabileceği gibi , nakledilen organlar veya kan nakli yoluyla da bulaşabilir . HCMV'nin çok bulaşıcı olmamasına rağmen, evlerde ve gündüz bakım merkezlerindeki küçük çocuklar arasında yayıldığı gösterilmiştir.
çoğaltma
HCMV, enfekte endotelyal hücrelerde yavaş bir hızda çoğalır ve hücre kültüründe yaklaşık 5 gün sürer . Diğer herpesvirüsler gibi , HCMV de genleri geçici olarak kontrollü bir şekilde ifade eder. Hemen erken genler (enfeksiyondan 0-4 saat sonra), transkripsiyonun düzenlenmesinde rol oynar , bunu viral DNA replikasyonu ve daha fazla transkripsiyonel düzenlemede yer alan erken genler (enfeksiyondan 4-48 saat sonra) takip eder . Geç genler, enfeksiyonun geri kalanında viral çıkışa kadar eksprese edilir ve tipik olarak yapısal proteinleri kodlar. HCMV kendi fonksiyonel DNA polimerazını kodlarken , virüs tüm genlerinin transkripsiyonu için konakçı RNA polimerazını kullanır.
Viral çift sarmallı DNA genomunun sentezi, özel viral replikasyon bölmeleri içindeki konak hücre çekirdeğinde meydana gelir .
HCMV suşu AD169 tarafından kodlanan genlerin yaklaşık %75'i silinebilir ve yine de enfeksiyöz virüs üretimi ile sonuçlanabilir. Bu, virüsün gecikmeye zamanında giriş için konakçı bağışıklık sisteminden kaçınmaya odaklandığını gösteriyor .
Risk altındaki popülasyonlar
CMV enfeksiyonları en çok perinatal dönemde ve bağışıklığı baskılanmış kişilerde önemlidir.
Hamilelik ve doğumsal enfeksiyon
HCMV, doğuştan anormalliklere yol açan dikey olarak bulaşan enfeksiyonlardan biridir . (Diğerleri: Toksoplazmoz , Kızamıkçık ve Herpes simpleks .) Konjenital HCMV enfeksiyonu , anne hamilelik sırasında birincil bir enfeksiyon geçirdiğinde ortaya çıkar.
Her 1000 canlı doğumdan 5'i enfekte. Yüzde beşi birden fazla handikap geliştirir ve kızamıkçık benzeri spesifik olmayan belirtilerle sitomegalik inklüzyon hastalığı geliştirir . Diğer bir yüzde beş daha sonra serebral kalsifikasyon geliştirir (IQ seviyelerini önemli ölçüde düşürür ve sensörinöral sağırlığa ve psikomotor gerilemeye neden olur).
Bununla birlikte, erken doğan ve doğumdan sonra HCMV ile enfekte olan bebekler, yaşamın ilerleyen dönemlerinde bilişsel ve motor bozukluklar yaşayabilir.
Bağışıklığı baskılanmış yetişkinler
Bağışıklık sistemleri zayıflamış kişilerde (örneğin organ nakli yapılmış veya ciddi şekilde yanmış kişilerde) CMV enfeksiyonu veya reaktivasyonu hastalığa neden olur ve ölüm riskini artırır.
CMV reaktivasyonu genellikle şiddetli koliti olan kişilerde görülür .
Bu kişilerde tanınan belirli hastalık varlıkları
- Fulminan karaciğer yetmezliğine neden olabilen CMV hepatiti
- sitomegalovirüs retiniti ( oftalmoskopide "pizza pastası görünümü" ile karakterize edilen retina iltihabı )
- sitomegalovirüs koliti ( kalın bağırsak iltihabı )
- CMV pnömonisi
- CMV özofajiti
- poliradikülopati, transvers miyelit ve subakut ensefalit
CMV ile enfekte donörlerden organ nakli yapılan CMV enfeksiyonu olmayan kişiler, valgansiklovir (ideal olarak) veya gansiklovir ile profilaktik tedavi ve artan bir CMV titresini tespit etmek için düzenli serolojik izleme gerektirir; tedavi edilirse, potansiyel olarak yaşamı tehdit eden bir enfeksiyonun erken oluşumu önlenebilir.
İmmünyetkili yetişkinler
CMV enfeksiyonları, yetişkin bağışıklığı yeterli popülasyonlarda hala klinik öneme sahip olabilir.
- CMV mononükleozu (bazı kaynaklar "mononükleoz"u yalnızca Epstein-Barr virüsü için saklar ). Bununla birlikte, CMV ile ilişkili mononükleoz sendromu tipik olarak genişlemiş servikal lenf nodları ve splenomegali belirtilerinden yoksundur .
- CMV ayrıca Guillain-Barré sendromu , tip 1 diyabet ve tip 2 diyabet ile ilişkilendirilmiştir.
Gizli CMV enfeksiyonunun sağlıklı olan insanlar üzerinde herhangi bir olumsuz etkisi olup olmadığı sorusu tartışılmıştır; 2016 itibariyle cevap net değildi, ancak tartışmalar gizli CMV'nin bazı kardiyovasküler hastalık ve kanser riskini artırıp artırmadığına odaklanmıştı .
patogenez
Doğumdan sonra HCMV ile enfekte olan çoğu sağlıklı insanda hiçbir semptom görülmez. Bazıları , uzun süreli ateş ve hafif hepatit ile bulaşıcı mononükleoz veya glandüler ateşe benzer bir sendrom geliştirir . Boğaz ağrısı yaygındır. Enfeksiyondan sonra virüs , kişinin hayatının geri kalanında vücuttaki lenfositlerde gizli kalır . Bağışıklık ilaçlar, enfeksiyon veya yaşlılık tarafından baskılanmadıkça, aşikar hastalık nadiren ortaya çıkar . Genellikle asemptomatik olan ilk HCMV enfeksiyonunu, virüsün saptanabilir bir hasara veya klinik hastalığa neden olmadan mononükleer hücrelerde bulunduğu uzun süreli, belirsiz bir enfeksiyon izler.
Bulaşıcı CMV, herhangi bir enfekte kişinin vücut sıvılarına dökülebilir ve idrar , tükürük , kan , gözyaşı , meni ve anne sütünde bulunabilir . Virüsün dökülme herhangi saptanabilir bulgu veya belirti olmadan, aralıklı olarak meydana gelebilir.
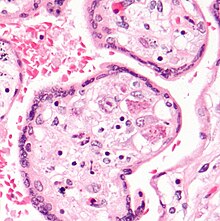
CMV enfeksiyonu, intranükleer inklüzyon cisimciklerinin saptanmasıyla mikroskobik olarak gösterilebilir . On H & E boyama cisimcikler, pembe, koyu leke ve "baykuş gözü" ara cisimcikler olarak adlandırılır.
HCMV enfeksiyonu bazı yüksek risk grupları için önemlidir. Başlıca enfeksiyon riski alanları arasında doğum öncesi veya doğum sonrası bebekler ve organ nakli alıcıları, lösemili kişiler veya insan immün yetmezlik virüsü ( HIV ) ile enfekte olanlar gibi bağışıklığı baskılanmış kişiler bulunur . HIV ile enfekte kişilerde HCMV, AIDS'i tanımlayan bir enfeksiyon olarak kabul edilir , bu da T hücre sayısının düşük seviyelere düştüğünü gösterir.
Litik olarak çoğalan virüsler hücre iskeletini bozar ve virüsün adının kaynağı olan büyük hücre büyümesine neden olur.
2009'da yayınlanan bir araştırma, CMV enfeksiyonunu farelerde yüksek tansiyonla ilişkilendiriyor ve insanlarda kan damarı endotelinin CMV enfeksiyonunun sonucunun aterosklerozun başlıca nedeni olduğunu öne sürüyor . Araştırmacılar ayrıca hücrelere CMV bulaştığında, yüksek tansiyona katkıda bulunduğu bilinen bir protein olan renin oluşturduklarını buldular .
CMV , NK hücre yanıtlarının immün kaçışında rol oynayan bir protein olan UL16'yı kodlar . Bu ligandlara bağlanan ULBP1 , ULBP2 ve MİKB NK hücre aktive reseptörünün NKG2D yüzey ekspresyonunu önler. Bu ligandlar, viral enfeksiyon gibi hücresel stres zamanlarında normal olarak yukarı doğru düzenlenir ve bunların yukarı regülasyonunu önleyerek CMV, konakçı hücresinin NK hücreleri nedeniyle ölmesini önleyebilir.
Bağışıklık sisteminin önemli bir kısmı, bağışıklık sisteminin kaynaklarını tüketen CMV'nin sürekli olarak kontrol edilmesinde rol oynar. Bulaşıcı hastalıktan ölüm oranları yaşla birlikte hızlanır ve CMV enfeksiyonu, aşılamanın etkinliğinin azalmasıyla ilişkilidir . En yüksek CMV antikor seviyelerine sahip kişiler, çok az antikoru olan veya hiç antikoru olmayan kişilerle karşılaştırıldığında, tüm nedenlerden dolayı çok daha yüksek ölüm riskine sahiptir.
Teşhis
CMV'li enfeksiyonların çoğu teşhis edilmez, çünkü virüs genellikle az sayıda semptom üretir ve semptomsuz olarak aralıklı olarak yeniden etkinleşme eğilimi gösterir. CMV ile enfekte olan kişiler , virüse karşı, o kişinin yaşamı boyunca vücutta kalan antikorlar geliştirir . Bu antikorları CMV'ye karşı saptayan bir dizi laboratuvar testi, enfeksiyonun oluşup oluşmadığını belirlemek için geliştirilmiştir ve ticari laboratuvarlardan yaygın olarak temin edilebilir. Ayrıca aktif enfeksiyonu saptamak için idrar, boğaz sürüntüleri, bronş lavajları ve doku örneklerinden elde edilen örneklerden virüs kültürü yapılabilir. CMV için hem kalitatif hem de kantitatif polimeraz zincir reaksiyonu (PCR) testi de mevcuttur ve doktorların CMV ile enfekte kişilerin viral yükünü izlemesine olanak tanır .
CMV pp65 antijenemi testi, periferik kan lökositlerinde sitomegalovirüsün pp65 proteinini tanımlamak için dolaylı bir immünofloresan tekniği kullanan immünofloresan bazlı bir tahlildir. CMV pp65 testi, antijenemi sonuçları semptomatik CMV hastalığının başlangıcından yaklaşık 5 gün önce alındığından, immünosupresif tedavi altında olan ve böbrek nakli ameliyatı geçirmiş kişilerde CMV enfeksiyonunu ve antiviral tedaviye yanıtını izlemek için yaygın olarak kullanılır. Bu tahlilin avantajı, sonuçların birkaç saat içinde sağlanmasındaki hızlılık ve pp65 antijen belirlemesinin, hekimin antiviral tedaviyi başlatması için yararlı bir kriteri temsil etmesidir. pp65 testinin en büyük dezavantajı, test serisi başına yalnızca sınırlı sayıda numunenin işlenebilmesidir.
Bir kişinin enfeksiyöz mononükleoz semptomları varsa ancak mononükleoz ve Epstein-Barr virüsü için negatif test sonuçları varsa veya hepatit belirtileri gösteriyorsa, ancak hepatit A , B ve C için negatif test sonuçları varsa CMV'den şüphelenilmelidir .
En iyi tanı sonuçları için, CMV antikoru için laboratuvar testleri, eşleştirilmiş serum örnekleri kullanılarak yapılmalıdır. CMV şüphesi üzerine bir kan örneği ve 2 hafta içinde bir kan örneği alınmalıdır. Kişi semptomatik olduğunda herhangi bir zamanda bir virüs kültürü yapılabilir. Bir kadının zaten CMV enfeksiyonu geçirip geçirmediğini belirlemek için CMV antikorları için laboratuvar testi yapılabilir. Bununla birlikte, tüm hamile kadınların rutin testleri maliyetlidir ve bu nedenle test ihtiyacı vaka bazında değerlendirilmelidir.
serolojik testler
Enzim bağlantılı immünosorbent tahlili (veya ELISA ), CMV'ye karşı antikoru ölçmek için en yaygın olarak bulunan serolojik testtir. Sonuç, bir bebekte akut enfeksiyon, önceki enfeksiyon veya pasif olarak edinilmiş maternal antikor olup olmadığını belirlemek için kullanılabilir. Diğer testler, çeşitli floresan deneyleri, dolaylı hemaglütinasyon , (PCR) ve lateks aglütinasyonu içerir .
CMV'ye özgü IgM için bir ELISA tekniği mevcuttur, ancak serum numunesi test edilmeden önce romatoid faktörü veya IgG antikorunun çoğunu çıkarmak için adımlar atılmazsa yanlış pozitif sonuçlar verebilir . CMV'ye özgü IgM, yeniden aktive edilmiş CMV enfeksiyonunda düşük seviyelerde üretilebildiğinden, varlığı her zaman birincil enfeksiyonun göstergesi değildir. Yalnızca akciğer gibi bir hedef organdan alınan virüs, mevcut hastalığın edinilmiş CMV enfeksiyonundan kaynaklandığına dair kesin kanıt sağlar. Serolojik testler pozitif veya yüksek IgG titresi saptarsa, bu sonuç otomatik olarak aktif CMV enfeksiyonunun mevcut olduğu şeklinde yorumlanmamalıdır. Eşleştirilmiş serum numunelerinin antikor testleri, IgG antikorunda dört kat artış ve önemli düzeyde IgM antikoru (IgG değerinin en az %30'una eşit) gösteriyorsa veya virüs idrardan kültürlenmişse aktif CMV enfeksiyonunun mevcut olduğu kabul edilir. veya boğaz örneği.
Kan bağışçılarına uygunluk
Yukarıda tartışılan riskler genellikle düşük olsa da, CMV testleri ABD, Birleşik Krallık ve diğer birçok ülkede yönlendirilmemiş kan bağışı (belirli bir kişi için belirtilmeyen bağışlar) için standart taramanın bir parçasıdır . CMV-negatif bağışlar daha sonra bebeklere veya bağışıklığı baskılanmış kişilere transfüzyon için tahsis edilir. Bazı kan bağışı merkezleri, özel talepler nedeniyle kanı CMV negatif olan bağışçıların listelerini tutmaktadır.
Kemik iliği bağışçılarına uygunluk
Allojenik hematopoietik kök hücre nakli sırasında , genellikle donör ve alıcının serostatusunun eşleşmesi önerilir. Alıcı seronegatif ise, seropozitif bir donör de novo enfeksiyon riski taşır. Tersine, seropozitif bir alıcı, seronegatif bir donörden bir nakil alırsa, bu süreçte doğuştan gelen savunmalarını kaybederse, viral reaktivasyon riski altındadır. Genel olarak, viral reaktivasyonun önemli bir morbidite nedeni olduğu CMV seropozitif alıcılar için risk en yüksektir. Bu nedenlerle, CMV serolojik testi hem kemik iliği donörleri hem de alıcılar için rutindir.
Önleme
aşı
Bir faz 2 çalışma 2009 yılında yayınlanan, bir CMV-aşı temin -the koruma sınırlı% 50'lik bir etkinlik gösterilir ve deneklerin sayısı aşılamadan rağmen CMV enfeksiyonu daralmıştır. Bir olguda da konjenital CMV ile karşılaşıldı.
2013 yılında Astellas Pharma , hematopoietik kök hücre nakli alan bireyler üzerinde CMV deoksiribonükleik asit DNA sitomegalovirüs aşısı ASP0113 ile bir faz 3 denemesine başladı.
2015 yılında Astellas Pharma, sitomegalovirüs aşısı ASP0113 ile sağlıklı gönüllüler üzerinde bir faz 1 denemesi başlattı.
Diğer sitomegalovirüs aşı adayları, CMV-MVA Tripleks aşısı ve CMVpp65-A*0201 peptid aşısıdır. Her iki aşı adayı da City of Hope Ulusal Tıp Merkezi tarafından desteklenmektedir . 2016 itibariyle, geliştirme klinik faz 2 deneme aşamasındadır.
hijyen
Hastalık Kontrol ve Önleme Merkezleri (CDC), özellikle çocuk bezini değiştirdikten sonra, düzenli el yıkama önerilir. Çocuğu besledikten, burnunu veya ağzını sildikten veya çocuk oyuncaklarını tuttuktan sonra da el yıkama önerilir.
Tedavi
CMV için zenginleştirilmiş hiperimmün globulin (CMV-IGIV), sitomegalovirüse karşı standart sayıda antikor içeren bir immünoglobulin G'dir (IgG). Böbrek, akciğer, karaciğer, pankreas ve kalp transplantasyonu ile ilişkili sitomegalovirüs hastalığının profilaksisi için kullanılabilir. Tek başına veya bir antiviral ajanla kombinasyon halinde, aşağıdakileri yaptığı gösterilmiştir:
- En yüksek riskli transplant alıcılarının bazılarında CMV ile ilgili hastalık ve ölüm riskini azaltın
- Ölçülebilir bir uzun vadeli hayatta kalma avantajı sağlayın
- Minimal tedavi ile ilgili yan etkiler ve advers olaylar üretin.
Gansiklovir (Cytovene) tedavisi, görme ile ilgili veya yaşamı tehdit eden hastalıkları olan, bağışıklığı baskılanmış kişilerde kullanılır. Valgansiklovir vücutta ganciclovir dönüştürülmüş olur bir ön-ilaç, fakat çok daha iyi bir ikinci daha oral emilir (valsit) da etkilidir ve ağızdan verilen bir antiviral ilaç. Terapötik etkinlik, ilaca dirençli virüs izolatlarının ortaya çıkmasıyla sıklıkla tehlikeye girer. UL97 protein kinazındaki ve viral DNA polimerazındaki çeşitli amino asit değişikliklerinin ilaç direncine neden olduğu bildirilmiştir. Foscarnet veya cidofovir , yalnızca gansiklovire dirençli CMV'si olan kişilere verilir, çünkü foscarnet'in belirgin nefrotoksisitesi vardır, bu da Ca 2+ veya PO 4 3− ' de artış veya azalma ve Mg 2+ seviyelerinde azalma ile sonuçlanır .
Letermovir , HCMV enfeksiyonunun tedavisi ve profilaksisi için Avrupa İlaç Ajansı ve FDA tarafından onaylanmıştır .
İlaç direnci
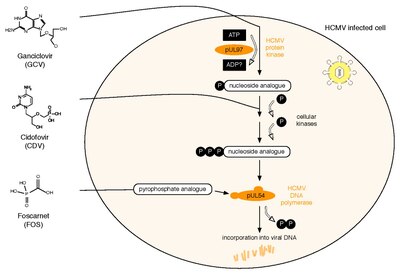
Halihazırda lisanslı üç anti-HCMV ilacının tümü , viral DNA polimerazı , pUL54'ü hedefler. Gansiklovir (GCV), nükleozid analoğu gibi davranır. Antiviral aktivitesi, HCMV protein kinaz pUL97 tarafından fosforilasyon gerektirir. İkinci ilaç, Cidofovir (CDV), zaten fosforlanmış ve dolayısıyla aktif olan bir nükleotid analoğudur. Son olarak, Foscarnet (FOS) farklı bir eylem moduna sahiptir. pUL54'ün pirofosfat bağlanma bölgesini bloke ederek polimeraz fonksiyonunu doğrudan inhibe eder (not: araştırma ilacı letermovir , viral terminaz içeren bir mekanizma yoluyla etki eder). İki HCMV proteini, bu üç ilaca karşı antiviral dirençle ilişkilendirilir: pUL97 ve pUL54. pUL97'deki spesifik mutasyonlar, bu viral protein kinazın fosforilasyon aktivitesinin azalmasına neden olabilir. Böylece, daha az monofosforile - ve dolayısıyla aktif - GCV sentezlenebilir ve bu da GCV'ye karşı antiviral dirence yol açar. Tüm GCV dirençlerinin yaklaşık %90'ı, UL97'deki bu tür mutasyonlardan kaynaklanır. pUL54'teki mutasyonlar, antiviral ilaç direncine yol açan farklı etkilere sahip olabilir : A. Antiviral bileşiklere afinitenin azalmasına yol açabilirler. Bu direnç mekanizması GCV, CDV ve FOS ile ilgilidir ve çoklu ilaç direncine yol açabilir. B. pUL54'teki bazı mutasyonlar, polimerazın eksonükleaz aktivitesini artırabilir . Bu, birleştirilmiş GCV ve CDV'nin daha iyi tanınmasına neden olur. Sonuç olarak, bu dNTP analogları daha verimli bir şekilde eksize edilir. HCMV ilaç direnci için başlıca risk faktörleri, konakçının bağışıklık sisteminin viral replikasyonu kontrol etme kapasitesi ve viral replikasyonun toplam miktarı ve süresidir. HCMV antiviral ilaç direnci, fenotipik veya genotipik ilaç direnci testi ile tespit edilebilir. Fenotipik direnç testi, EC50 değerlerini belirlemek için virüsün hücre kültüründe yetiştirilmesini ve duyarlılığının farklı antiviral ilaç konsantrasyonları kullanılarak test edilmesini içerir . Buna karşılık, genotipik direnç testi, dizileme yoluyla UL97 ve UL54'te dirençle ilişkili mutasyonların saptanması anlamına gelir . Genotipik direnç testi, daha hızlı olduğu için tercih edilen yöntem haline geliyor, ancak her yeni bulunan mutasyonun önceki fenotipik karakterizasyonunu gerektiriyor. Bu, bir kişinin HCMV dizisini yayınlanmış tüm UL97 ve UL54 mutasyonlarını ve karşılık gelen antiviral ilaca duyarlılık fenotiplerini içeren bir veri tabanına bağlayan web tabanlı bir arama aracı aracılığıyla gerçekleştirilebilir .
epidemiyoloji
Amerika Birleşik Devletleri'nde, CMV enfeksiyonu, 6 yaşında enfekte olan kişilerin yaklaşık %60'ından yaşla birlikte yükselir ve 75-80 yaşları arasında nüfusun yaklaşık %85-90'ında dengelenir.
Referanslar
Dış bağlantılar
- İnsan betaherpesvirus 5 at Curlie
- Sitomegalovirüs (CMV) ABD Hastalık Kontrol ve Önleme Merkezleri (CDC). 22 Mayıs 2009
- HCMV ilaç direnci mutasyonları aracı
- " İnsan herpes virüsü 5 " . NCBI Taksonomi Tarayıcısı . 10359.
| sınıflandırma |
|---|