glioblastom - Glioblastoma
| glioblastom | |
|---|---|
| Diğer isimler | Glioblastoma multiforme, derece IV astrositom |
 | |
| 15 yaşında bir erkekte glioblastoma kontrastlı koronal MRG | |
| uzmanlık | Nöro-onkoloji , beyin cerrahisi |
| Belirtiler | Başlangıçta nonspesifik, baş ağrıları , kişilik değişiklikleri, mide bulantısı , felce benzer semptomlar |
| Her zamanki başlangıç | ~ 64 yaşında |
| nedenler | Genellikle belirsiz |
| Risk faktörleri | Genetik bozukluklar ( nörofibromatozis , Li-Fraumeni sendromu ), önceki radyasyon tedavisi |
| teşhis yöntemi | BT taraması , MRI taraması , doku biyopsisi |
| Önleme | Bilinmeyen |
| Tedavi | Cerrahi , kemoterapi , radyasyon |
| İlaç tedavisi | Temozolomid , steroidler |
| prognoz | Yaşam beklentisi ~ 14 ay tedavi ile (5 yıllık sağkalım <%7) |
| Sıklık | Yılda 100.000'de 3 |
Glioblastoma multiforme ( GBM ) olarak da bilinen glioblastoma , beyinde başlayan en agresif kanser türüdür . Başlangıçta, glioblastomun belirti ve semptomları spesifik değildir. Baş ağrıları , kişilik değişiklikleri, mide bulantısı ve inmeye benzer semptomlar içerebilirler . Semptomlar sıklıkla hızla kötüleşir ve bilinç kaybına kadar ilerleyebilir .
Çoğu glioblastoma vakasının nedeni bilinmemektedir. Yaygın olmayan risk faktörleri arasında nörofibromatozis ve Li-Fraumeni sendromu gibi genetik bozukluklar ve önceki radyasyon tedavisi yer alır . Glioblastomlar, tüm beyin tümörlerinin %15'ini temsil eder . Normal beyin hücrelerinden başlayabilir veya mevcut düşük dereceli astrositomdan gelişebilirler . Tanı tipik olarak bir CT taraması , MRI taraması ve doku biyopsisinin bir kombinasyonu ile konur .
Kanserden korunmanın bilinen bir yöntemi yoktur. Tedavi genellikle ameliyatı içerir , ardından kemoterapi ve radyasyon tedavisi kullanılır. İlaç temozolomid sıklıkla kemoterapinin bir parçası olarak kullanılır. Şişmeyi azaltmak ve semptomları azaltmak için yüksek doz steroidler kullanılabilir. Tümörün cerrahi olarak çıkarılması (dekompresyon), sağkalımın artmasıyla bağlantılıdır, ancak sadece birkaç ay.
Maksimum tedaviye rağmen, kanser her zaman tekrarlar . Tanıyı takiben tipik sağkalım süresi 12-15 aydır ve insanların %3-7'sinden daha azı beş yıldan uzun süre hayatta kalır. Tedavi olmadan, hayatta kalma tipik olarak üç aydır. Beyinde başlayan en yaygın kanser ve meningiomdan sonra en sık görülen ikinci beyin tümörüdür . Her 100.000 kişiden yaklaşık 3'ü hastalığa yakalanır. Ortalama tanı yaşı 64'tür ve hastalık erkeklerde kadınlardan daha sık görülür. İmmünoterapi , kanser tedavisi olarak incelenmektedir.
Belirti ve bulgular
Yaygın semptomlar nöbetler , baş ağrıları, mide bulantısı ve kusma , hafıza kaybı , kişilik, ruh hali veya konsantrasyon değişiklikleri ve lokalize nörolojik sorunları içerir. Üretilen semptomların türü, patolojik özelliklerinden çok tümörün konumuna bağlıdır. Tümör hızla semptom üretmeye başlayabilir, ancak bazen çok büyük bir boyuta ulaşana kadar asemptomatik bir durumdur .
Risk faktörleri
Çoğu vakanın nedeni belirsizdir. Yaklaşık %5'i, düşük dereceli astrositom olarak bilinen başka bir beyin tümörü tipinden gelişir.
Genetik
Yaygın olmayan risk faktörleri arasında nörofibromatozis, Li-Fraumeni sendromu, tüberoskleroz veya Turcot sendromu gibi genetik bozukluklar yer alır . Önceki radyasyon tedavisi de bir risktir. Bilinmeyen nedenlerle, erkeklerde daha sık görülür.
çevre
Diğer dernekler arasında sigara içmeye , böcek ilaçlarına maruz kalma ve petrol arıtma veya kauçuk imalatında çalışma yer alır .
Glioblastoma, SV40 , HHV-6 ve sitomegalovirüs virüsleriyle ilişkilendirilmiştir .
Başka
Kürlenmiş et tüketiminin bir risk faktörü olup olmadığını görmek için araştırmalar yapılmıştır . 2013 itibariyle hiçbir risk teyit edilmemiştir. Benzer şekilde, tıbbi görüntüleme sırasında radyasyona maruz kalma , formaldehit ve cep telefonları ve evlerdeki elektrik kabloları gibi konut elektromanyetik alanları , risk faktörleri olarak incelenmiştir. 2015 itibariyle, GBM'ye neden oldukları gösterilmemiştir. Bununla birlikte, 2007'de yayınlanan bir meta-analiz, GBM'lerin oranı ile 10 yıldan uzun süre cep telefonu kullanımı arasında, özellikle telefonu her zaman başlarının bir tarafında tutanlar arasında bir ilişki buldu.
patogenez
Glioblastomun hücresel kökeni bilinmemektedir. İçinde benzerlikleri nedeniyle immunboyama ait glial hücrelerden glioblastoma uzun glial tip hücrelerden köken kabul edilmiş olarak ve glioblastoma, gliyom. Daha yeni çalışmalar, astrositlerin , oligodendrosit progenitör hücrelerin ve nöral kök hücrelerin hepsinin menşe hücresi olarak hizmet edebileceğini göstermektedir.
Glioblastomalar, anaplastik hücrelerle çevrili küçük nekrotizan doku alanlarının varlığı ile karakterize edilir . Bu özellik ve hiperplastik kan damarlarının varlığı , tümörü bu özelliklere sahip olmayan 3. derece astrositomlardan ayırır.
GBM'ler genellikle serebral beyaz cevherde oluşur, hızla büyür ve semptom üretmeden önce çok büyüyebilir. Düşük dereceli astrositom veya anaplastik astrositom dejenerasyonunu takiben %10'dan daha azı daha yavaş oluşur . Bunlara ikincil GBM denir ve daha genç hastalarda daha sık görülür (ortalama yaş 45'e karşı 62 yıl). Tümör , beyin omurilik sıvısında (BOS) yüksek protein içeriğine (> 100 mg/dl) ve ayrıca çoğunlukla lenfositler olmak üzere 10 ila 100 hücrenin ara sıra pleositozuna yol açarak meninkslere veya ventriküler duvara uzanabilir . BOS içinde taşınan kötü huylu hücreler (nadiren) omuriliğe yayılabilir veya meningeal gliomatozise neden olabilir. Bununla birlikte, GBM'nin merkezi sinir sisteminin ötesine metastazı son derece sıra dışıdır. GBM'lerin yaklaşık %50'si bir yarım kürenin birden fazla lobunu kaplar veya iki taraflıdır. Bu tip tümörler genellikle beyinden kaynaklanır ve korpus kallozum boyunca klasik infiltrasyon sergileyerek bir kelebek (bilateral) glioma üretebilir .
Glioblastoma sınıflandırması
Beyin tümörü sınıflandırması geleneksel olarak hematoksilen-eozin kesitlerinde ölçülen makroskopik düzeyde histopatolojiye dayanmaktadır . Dünya Sağlık Örgütü 1979 yılında ilk standart sınıflandırma yayınlanan ve böylece beri yapıyor. Merkezi Sinir Sistemi Tümörlerinin 2007 WHO Sınıflandırması, esas olarak mikroskopi özelliklerine dayanan son sınıflandırmaydı. Yeni 2016 DSÖ Merkezi Sinir Sistemi Tümörleri Sınıflandırması bir paradigma değişikliğiydi: tümörlerin bazıları, hücre morfolojilerinin yanı sıra genetik bileşimleri ile de tanımlandı.
Gliomaların derecelendirilmesi önemli ölçüde değişti ve glioblastoma artık esas olarak izositrat dehidrojenaz (IDH) mutasyonunun durumuna göre sınıflandırıldı : IDH-vahşi tip veya IDH-mutant.
| IDH-yabani tip glioblastoma | IDH-mutant glioblastoma | |
|---|---|---|
| Eşanlamlı sözcük | Birincil glioblastom | ikincil glioblastom |
| öncü lezyon | Tanımlanmış de novo | Diffüz astrositom
anaplastik astrositom |
| Glioblastomların oranı | ~%90 | ~%10 |
| Ortanca tanı yaşı | ~62 yıl | ~44 yıl |
| Erkek:Kadın oranı | 1.42:1 | 1.05:1 |
| Tanı anındaki klinik öykünün medyan uzunluğu | 4 ay | 15 ay |
| Medyan genel sağkalım | ||
| Cerrahi + radyoterapi | 9,9 ay | 24 ay |
| Cerrahi + radyoterapi + kemoterapi | 15 ay | 31 ay |
| Konum | supratentoryal | Tercihen önden |
| Nekroz | Yaygın | Sınırlı |
| TERT promotör mutasyonları | %72 | %26 |
| TP53 mutasyonları | %27 | %81 |
| ATRX mutasyonları | olağanüstü | %71 |
| EGFR amplifikasyonu | %35 | olağanüstü |
| PTEN mutasyonları | %24 | olağanüstü |
Moleküler değişiklikler
Gen ekspresyonuna dayalı olarak dört glioblastoma alt tipi tanımlanmıştır:
- Klasik: Bu alt tipteki tümörlerin yaklaşık %97'si epidermal büyüme faktörü reseptörü ( EGFR ) geninin fazladan kopyalarını taşır ve çoğu normalden daha yüksek EGFR ekspresyonuna sahiptir , oysa sıklıkla glioblastomada mutasyona uğrayan TP53 (p53) geni Bu alt tipte nadiren mutasyona uğrar. Kromozom 10'daki heterozigotluk kaybı , klasik alt tipte kromozom 7 amplifikasyonunun yanı sıra sıklıkla görülür.
- Proneural alt tipi genellikle değişiklikler yüksek oranları TP53 (p53) ve PDGFRA olarak, genin bir tipi kodlayan trombosit kaynaklı büyüme faktörü reseptörü ve IDH1 olarak, gen kodlayan izositrat dehidrojenaz -1.
- Mezenkimal alt türü mutasyonları ya da başka değişikliğin yüksek oranları ile karakterize edilir NF1 kodlayan gen nörofibromin 1 ve daha az değişiklik olarak , EGFR gen ve daha az ifade EGFR diğer tipleri üzerinde.
- Nöral alt tip, NEFL , GABRA1 , SYT1 ve SLC12A5 gibi nöron belirteçlerinin ekspresyonu ile belirlenirken , genellikle patolojik değerlendirmede kendilerini normal hücreler olarak sunarlar .
Glioblastomada birçok başka genetik değişiklik tarif edilmiştir ve bunların çoğu, RB ve PI3K/AKT olmak üzere iki yolakta kümelenmiştir . Glioblastomalar, bu yolların sırasıyla %68-78 ve %88'inde değişikliklere sahiptir.
Bir diğer önemli değişiklik , bir "intihar" DNA onarım enzimi olan MGMT'nin metilasyonudur . Metilasyon, DNA transkripsiyonunu ve MGMT geninin ekspresyonunu bozar. MGMT enzimi intihar onarım mekanizması nedeniyle sadece bir DNA alkilasyonunu onarabildiğinden, rezerv kapasitesi düşüktür ve MGMT gen promotörünün metilasyonu DNA onarım kapasitesini büyük ölçüde etkiler. MGMT metilasyonu, temozolomid gibi DNA'ya zarar veren kemoterapötiklerle tedaviye daha iyi bir yanıt ile ilişkilidir.
Kanser kök hücreleri
Progenitör hücrelere (glioblastoma kanseri kök hücreleri ) benzer özelliklere sahip glioblastoma hücreleri , glioblastomlarda bulunmuştur. Bunların mevcudiyeti, glioblastomun yaygın doğası ile birleştiğinde, bunların ameliyatla tamamen çıkarılmasında güçlükle sonuçlanır ve bu nedenle, geleneksel tedavilere direncin ve yüksek nüks oranının arkasındaki olası neden olduğuna inanılmaktadır. Glioblastoma kanseri kök hücreleri, her ikisi de yüzey reseptörü CD133'ü eksprese eden nöral progenitör hücrelerle biraz benzerlik gösterir. CD44 ayrıca glioblastoma tümör hücrelerinin bir alt kümesinde bir kanser kök hücre belirteci olarak da kullanılabilir. Glioblastoma kanseri kök hücrelerinin, en azından kısmen, DNA hasar yanıtının yukarı regülasyonu yoluyla, radyoterapi ve kemoterapi aracılılığına karşı gelişmiş direnç gösterdiği görülmektedir .
Metabolizma
IDH1 enzimi için geni kodlar izositrat dehidrojenez 1 ve nadiren glioblastoma mutasyona uğramıştır (:% 5, ikinci GBM>% 80 birincil GBM). "Oncometabolite" D-2-hidroksiglutarat ve vahşi tip IDH1 enzimin fonksiyonunu dysregulating, bu metabolizmasına derin değişiklikler indükleyen çok yüksek konsantrasyonlarda üreterek IDH1 ile karşılaştırıldığında, glioblastoma -mutated IDH1 vahşi tip gliyoblastoma ya da sağlıklı astrositlerin . Diğerlerinin yanı sıra, glioblastoma hücrelerinin bir enerji kaynağı olarak glutamin veya glutamat bağımlılığını arttırır . IDH1 glioblastomlar glutamat için çok yüksek bir talep vardır ve kemotaktik sinyal olarak, bu amino asit ve nörotransmitter kullanımı düşünülmektedir -mutated. Sağlıklı astrositler ifraz glutamat beri IDH1 glioblastoma hücreleri yoğun tümör yapıları lehine değil -mutated, ancak bunun yerine geçirmek, istila ve glutamat konsantrasyonları daha yüksektir beynin sağlıklı bölüme Dispers. Bu durum, bu invazif davranışını açıklayabilir IDH1 -mutated glioblastoma.
iyon kanalları
Ayrıca GBM, gBK potasyum kanallarının ve ClC-3 klorür kanallarının yukarı regülasyonu dahil olmak üzere iyon kanallarını kodlayan genlerde çok sayıda değişiklik sergiler. Bu iyon kanalları yukarı doğru düzenlenmesiyle, glioblastoma tümör hücrelerinin hücre zarı boyunca yüksek iyon hareketi, bu şekilde artan lH kolaylaştırmak için öne sürülen 2 çok hızlı bir şekilde hücre hacmini değiştirmek glioblastoma hücreleri yardımcı osmoz yoluyla O hareketi. Bu onların aşırı agresif istilacı davranışlarında yardımcı olur, çünkü hücresel hacimdeki hızlı adaptasyonlar, beynin kıvrımlı hücre dışı matrisi boyunca hareketi kolaylaştırabilir.
mikroRNA
2012 itibariyle, RNA etkileşimi, genellikle mikroRNA, doku kültürü, patoloji numuneleri ve glioblastomanın klinik öncesi hayvan modellerinde araştırılmaktadır. Ek olarak, deneysel gözlemler, mikroRNA-451'in kültürlenmiş glioma hücrelerinde LKB1/AMPK sinyalleşmesinin anahtar düzenleyicisi olduğunu ve miRNA kümelenmesinin hastalıktaki epigenetik yolları kontrol ettiğini göstermektedir.
tümör damar sistemi
GBM, bozulmuş morfoloji ve işlevsellik sunan anormal damarlarla karakterizedir. Vaskülatürün yüksek geçirgenliği ve zayıf perfüzyonu, tümör içinde düzensiz kan akışına neden olur ve artan hipoksiye yol açabilir, bu da immünosupresyon gibi süreçleri teşvik ederek kanserin ilerlemesini kolaylaştırır.
Teşhis

MRG ile bakıldığında, glioblastomlar sıklıkla halka güçlendirici lezyonlar olarak görünür. Bununla birlikte, apse , metastaz , tümefaktif multipl skleroz ve diğer antiteler gibi diğer lezyonlar benzer bir görünüme sahip olabileceğinden, görünüm spesifik değildir . BT veya MRG'de şüpheli bir GBM'nin kesin tanısı, stereotaktik biyopsi veya tümör rezeksiyonu ve patolojik doğrulama ile bir kraniyotomi gerektirir . Tümör derecesi tümörün en habis kısmına dayandığından biyopsi veya subtotal tümör rezeksiyonu lezyonun düşük derecelendirilmesine neden olabilir. Perfüzyon MRG kullanılarak tümör kan akışının görüntülenmesi ve MR spektroskopisi ile tümör metabolit konsantrasyonunun ölçülmesi , belirli vakalarda sırasıyla artan nispi serebral kan hacmi ve artan kolin piki göstererek standart MRG'ye tanısal değer katabilir, ancak patoloji tanı ve moleküler için altın standart olmaya devam etmektedir. karakterizasyon.
Primer glioblastomu sekonder glioblastomdan ayırt etmek önemlidir. Bu tümörler kendiliğinden oluşur ( de novo ) veya sırasıyla daha düşük dereceli bir gliomadan ilerlemiştir. Primer glioblastomlar daha kötü bir prognoza ve farklı tümör biyolojisine sahiptir ve tedaviye farklı bir yanıt verebilir, bu da bunu hasta prognozunu ve tedavisini belirlemek için kritik bir değerlendirme haline getirir. Sekonder glioblastomların %80'inden fazlası IDH1'de bir mutasyon taşırken , bu mutasyon primer glioblastomda nadirdir (%5-10). Bu nedenle, IDH1 mutasyonları, histopatolojik olarak çok benzer oldukları ve moleküler biyobelirteçler olmadan ayrım güvenilir olmadığı için, birincil ve ikincil glioblastomları ayırt etmek için yararlı bir araçtır.
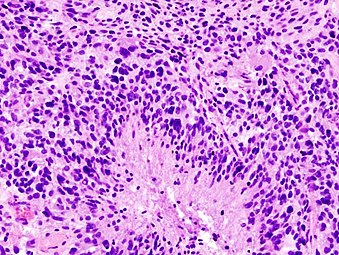
H&E boyasında pembe fibriler arka planda desensiz bir düzenlemeye sahip hücrelerle, belirgin nükleer pleomorfizm, çoklu mitoz (biri beyaz okta) ve çok çekirdekli hücreler (biri siyah okta) gibi yüksek dereceli astrositom özellikleri gösteren glioblastom histopatolojisi .
Düşük büyütme histopatolojisi, tümör hücrelerinin psödopalizatlarıyla çevrili nekrozu gösteren , anaplastik astrositomdan ziyade glioblastoma teşhisini veren .
Önleme
Glioblastomayı önlemek için bilinen bir yöntem yoktur. Diğer bazı kanser türlerinin aksine, çoğu glioma için önceden uyarı yapılmadan meydana gelirler ve bunları önlemenin bilinen bir yolu yoktur.
Tedavi
Glioblastoma tedavisi, birkaç karmaşık faktör nedeniyle zordur:
- Tümör hücreleri geleneksel tedavilere dirençlidir.
- Beyin, geleneksel tedaviden kaynaklanan hasara karşı hassastır.
- Beynin kendini tamir etme kapasitesi sınırlıdır.
- Birçok ilaç , tümör üzerinde etkili olmak için kan-beyin bariyerini geçemez .
Primer beyin tümörlerinin tedavisi, palyatif (semptomatik) bakım ve sağkalımı iyileştirmeye yönelik tedavilerden oluşur.
semptomatik tedavi
Destekleyici tedavi, semptomları hafifletmeye ve hastanın nörolojik fonksiyonunu iyileştirmeye odaklanır. Birincil destekleyici ajanlar antikonvülsanlar ve kortikosteroidlerdir .
- Tarihsel olarak, glioblastoma hastalarının yaklaşık %90'ı antikonvülzan tedavi görmüştür, ancak hastaların yalnızca tahminen %40'ı bu tedaviye ihtiyaç duymuştur. Son zamanlarda, beyin cerrahlarına, antikonvülzanların profilaktik olarak uygulanmaması ve bu ilacı reçete etmeden önce bir nöbet meydana gelene kadar beklemeleri önerilmiştir. Radyasyonla birlikte fenitoin alan hastalarda eritema multiforme ve Stevens-Johnson sendromu gibi ciddi cilt reaksiyonları olabilir .
- Kortikosteroidler, genellikle deksametazon , peritümöral ödemi azaltabilir (kan-beyin bariyerinin yeniden düzenlenmesi yoluyla), kütle etkisini azaltabilir ve kafa içi basıncını düşürebilir, baş ağrısı veya uyuşuklukta bir azalma ile.
Ameliyat
Cerrahi, glioblastoma tedavisinin ilk aşamasıdır. Ortalama bir GBM tümör 10 içeren 11 ila 10 düşük ortalama bir hücre, 9 ameliyat sonrası hücreler (% 99 azalma). Cerrahinin faydaları arasında patolojik bir teşhis için rezeksiyon, kitle etkisine bağlı semptomların hafifletilmesi ve radyoterapi ve kemoterapiye ikincil direnç oluşmadan önce hastalığın potansiyel olarak ortadan kaldırılması yer alır.
Tümör çıkarma derecesi ne kadar büyükse, o kadar iyidir. Geriye dönük analizlerde, tümörün %98 veya daha fazlasının çıkarılması, tümörün %98'den daha azının çıkarılmasından önemli ölçüde daha uzun daha sağlıklı bir süre ile ilişkilendirilmiştir. Ameliyat, 5-aminolevulinik asit olarak bilinen bir floresan boya tarafından yönlendirilirse, tümörün neredeyse tamamen ilk çıkarılma şansı artabilir . GBM hücreleri tanı anında beyin yoluyla geniş ölçüde infiltratiftir, bu nedenle tüm bariz tümörün "toplam rezeksiyonu" olmasına rağmen, GBM'li çoğu insan daha sonra ya orijinal bölgenin yakınında ya da beyin içinde daha uzak yerlerde tekrarlayan tümörler geliştirir. Diğer yöntemler, tipik olarak radyasyon ve kemoterapi, ameliyattan sonra tekrarlayan hastalığı bastırmak ve yavaşlatmak için kullanılır.
Radyoterapi
Ameliyattan sonra, radyoterapi, glioblastoma hastaları için tedavinin temel dayanağı haline gelir. Tipik olarak temozolomid verilmesi ile birlikte yapılır . 1970'lerin başında gerçekleştirilen önemli bir klinik araştırma, radyasyon tedavisine veya radyasyonsuz tedaviye randomize edilen 303 GBM hastası arasında, radyasyon alanların medyan sağkalımının, almayanların iki katından fazla olduğunu gösterdi. Daha sonraki klinik araştırmalar, cerrahinin omurgasını ve ardından radyasyonu oluşturmaya çalıştı. Ortalama olarak, radyoterapi ameliyat sonrası 10 tümör büyüklüğünü azaltabilir 7 hücreleri. Tüm beyin radyoterapisi, daha kesin ve hedefe yönelik üç boyutlu konformal radyoterapi ile karşılaştırıldığında iyileşmez. Toplam 60-65 Gy radyasyon dozunun tedavi için optimal olduğu bulunmuştur.
GBM tümörlerinin, radyoterapiye oldukça dirençli, hipoksi sergileyen doku bölgeleri içerdiği iyi bilinmektedir . 2016 itibariyle, kemoterapi radyosensitizörlerine yönelik çeşitli yaklaşımlar sınırlı bir başarı ile takip edilmiştir. 2010 itibariyle, daha yeni araştırma yaklaşımları , trans sodyum krosetinat gibi bir oksijen difüzyonunu arttırıcı bileşiğin radyosensitizörler olarak kullanımına ilişkin klinik öncesi ve klinik araştırmaları içeriyordu ve 2015 itibariyle a. klinik deney yapılıyordu. Bor nötron yakalama tedavisi , glioblastoma için alternatif bir tedavi olarak test edilmiştir, ancak yaygın olarak kullanılmamaktadır.
Kemoterapi
Çoğu çalışma kemoterapinin eklenmesinden hiçbir fayda göstermemektedir. Bununla birlikte, standart radyasyona karşı radyasyon artı temozolomid kemoterapisine randomize edilen 575 katılımcıdan oluşan büyük bir klinik çalışma, temozolomid alan grubun medyan olarak 14.6 ay hayatta kaldığını, tek başına radyasyon alan grup için 12.1 ay olduğunu göstermiştir. Bu tedavi rejimi, kişinin bir klinik araştırmaya dahil edilmediği çoğu glioblastoma vakası için artık standarttır . Temozolomid, tümör hücrelerini radyasyona duyarlı hale getirerek çalışıyor gibi görünüyor ve MGMT promotör metilasyonu olan tümörler için daha etkili görünüyor . Yüksek dereceli gliomalarda yüksek dozlarda temozolomid düşük toksisite sağlar, ancak sonuçlar standart dozlarla karşılaştırılabilir. Bevacizumab kontrol semptomları gibi ilaçlarla antianjiyogenik tedavi , ancak glioblastoma hastalarında genel sağkalımı etkilemiyor gibi görünmektedir. 2019 itibariyle anti-anjiyojenik tedavilerin genel faydası belirsizdir. Yeni teşhis edilmiş glioblastomlu, makul ölçüde uygun olan yaşlı kişilerde, eşzamanlı ve adjuvan kemoradyoterapi en iyi genel sağkalımı sağlar, ancak tek başına radyoterapiden daha fazla hematolojik advers olay riski ile ilişkilidir.
kannabinoidler
Kannabinoidlerin (kenevir türevleri) etkinliği onkolojide (tetrahidrokannabinol (THC) kapsülleri veya sentetik analog nabilon aracılığıyla), bir yandan kemoterapinin neden olduğu mide bulantısı ve kusmayla mücadele etmek, diğer yandan iştahı uyarmak ve duyuyu azaltmak için bilinir. ıstırap veya gerçek acı. Fare modellerinde malign gliomalarda büyüme ve anjiyogenezi inhibe etme yetenekleri gösterilmiştir. Tekrarlayan glioblastomlu son dönem hastalarda THC kullanımına ilişkin bir pilot çalışmanın sonuçları, daha fazla çalışmaya değer göründü. Gelecekteki araştırmalar için potansiyel bir yol, kannabinoidlerin fare modellerinde glioblastomanın neoplastik kök hücrelerine saldırabildiğinin keşfine dayanır, bunun sonucunda bir yandan daha olgun, muhtemelen daha "tedavi edilebilir" hücrelere farklılaşmalarını indükler ve diğer yandan tümör oluşumunu engellemek için.
Diğer prosedürler
Alternatif elektrik alan tedavisi , yeni teşhis edilen ve tekrarlayan glioblastoma için FDA onaylı bir tedavidir. 2015 yılında, yeni teşhis edilen glioblastomda alternatif elektrik alan tedavisi artı temozolomidin kullanıldığı bir faz-üç randomize klinik denemesinden elde edilen ilk sonuçlar, tek başına temozolomid tedavisine kıyasla progresyonsuz sağkalımda üç aylık bir iyileşme ve genel sağkalımda beş aylık bir iyileşme bildirdi , bu ortamda bir hayatta kalma gelişimi gösteren on yıldaki ilk büyük denemeyi temsil ediyor. Bu sonuçlara rağmen, bu yaklaşımın etkinliği tıp uzmanları arasında tartışmalıdır. Bununla birlikte, alternatif elektrik alan tedavisinin anti-kanser etkileri uyguladığı ve ekstra-kraniyal kanserlerde devam eden Faz 3 klinik deneylerinden elde edilen sonuçların mekanik temeline ilişkin artan anlayış, gelecekte glioblastoma tedavisi için artan klinik kabulü kolaylaştırmaya yardımcı olabilir.
Bir Tel Aviv Üniversitesi araştırması, P-selektin proteininin farmakolojik ve moleküler inhibisyonunun , glioblastomanın fare modellerinde tümör büyümesinin azalmasına ve sağkalımın artmasına yol açtığını gösterdi. Bu araştırmanın sonuçları, crizanlizumab gibi bu proteini inhibe eden ilaçlarla olası tedavilere açılabilir .
prognoz
Teşhisi takiben en yaygın hayatta kalma süresi 12 ila 15 aydır ve insanların %3 ila 7'sinden daha azı beş yıldan daha uzun süre hayatta kalır. Amerika Birleşik Devletleri'nde 2012 ve 2016 yılları arasında beş yıllık sağkalım %6,8 idi. Tedavi olmadan, hayatta kalma tipik olarak 3 aydır. Tam tedaviler son derece nadirdir, ancak bildirilmiştir. Şu anda Amerika Birleşik Devletleri'nde 20 yıldan uzun süredir bu hastalıkla yaşayan bir kişi var.
Artan yaş (> 60 yaş) daha kötü prognostik risk taşır. Ölüm genellikle serebral ödem ve artan kafa içi basıncı ile birlikte yaygın tümör infiltrasyonuna bağlıdır .
İyi bir ilk Karnofsky performans puanı (KPS) ve MGMT metilasyonu , daha uzun hayatta kalma ile ilişkilidir. DNA testi olup olmadığını belirlemek için glioblastoma ile yapılabilir promotör bölgesinin YÖNETİMİ geninin bir metile . Metillenmiş bir MGMT promotörü olan hastalar, kısmen temozolomide karşı artan hassasiyet nedeniyle, metillenmemiş bir MGMT promotörü olan hastalara göre daha uzun sağkalıma sahiptir. Glioblastoma hastaları için olumlu bir başka işaretleyici mutasyonu olan IDH1 en yaygın mutasyon, yani IDH1-R132H karşı bir antikor kullanılarak DNA-bazlı yöntemler ile veya imünohistokimya ile test edilebilir gen.
Daha prognostik güç mutasyonel durumunu birleştirilmesiyle elde edilebilir IDH1 ve metilasyon durumunu MGMT iki gen prediktör olarak. Hem IDH1 mutasyonları hem de MGMT metilasyonu olan hastalar en uzun hayatta kalma süresine sahiptir, bir IDH1 mutasyonu veya MGMT metilasyonu olan hastalar bir orta hayatta kalma süresine sahiptir ve herhangi bir genetik olayı olmayan hastalar en kısa sağkalıma sahiptir.
Ameliyat, radyoterapi ve temozolomid kemoterapisi alan hastalarla da uzun vadeli faydalar ilişkilendirilmiştir. Bununla birlikte, bazı hastaların neden glioblastoma ile daha uzun süre hayatta kaldığına dair pek çok şey bilinmiyor. 50 yaş altı GBM'de daha uzun sağkalım ile bağlantılıdır, %98+ rezeksiyon ve temozolomid kemoterapisinin kullanımı ve daha iyi KPS'ler. Yakın zamanda yapılan bir çalışma, daha genç yaşın çok daha iyi bir prognoz ile ilişkili olduğunu ve 40 yaşın altındaki hastaların küçük bir bölümünün popülasyona dayalı bir tedavi sağladığını doğrulamaktadır. Tedavinin, bir kişinin ölüm riskinin normal popülasyonunkine döndüğü zaman gerçekleştiği düşünülür ve GBM'de bunun 10 yıl sonra meydana geldiği düşünülür.
UCLA Nöro-onkoloji, bu tanıya sahip hastalar için gerçek zamanlı sağkalım verilerini yayınlar.
2003 tarihli bir araştırmaya göre, GBM prognozu KPS'ye, hastanın yaşına ve tedaviye bağlı olarak üç alt gruba ayrılabilir.
| Özyinelemeli bölümleme analizi (RPA) sınıfı |
Tanım | Tarihsel Medyan Hayatta Kalma Süresi | Tarihsel 1 Yıllık Hayatta Kalma | Tarihsel 3 Yıllık Hayatta Kalma | Tarihsel 5 Yıllık Hayatta Kalma |
|---|---|---|---|---|---|
| III | Yaş < 50, KPS ≥ 90 | 17,1 ay | %70 | %20 | %14 |
| IV | Yaş < 50, KPS < 90 | 11,2 ay | %46 | %7 | %4 |
| Yaş ≥ 50, KPS ≥ 70, iyi nörolojik fonksiyon ile cerrahi olarak çıkarılması | |||||
| V + VI | Yaş ≥ 50, KPS ≥ 70, kötü nörolojik fonksiyon ile cerrahi olarak çıkarma | 7,5 ay | %28 | %1 | %0 |
| Yaş ≥ 50, KPS ≥ 70, cerrahi olarak çıkarılma yok | |||||
| Yaş ≥ 50, KPS < 70 |
epidemiyoloji
Bölgesel sıklık çok daha yüksek olsa da, yılda yaklaşık 100.000 kişiden üçü hastalığa yakalanır. İngiltere'deki frekans 1995 ve 2015 yılları arasında ikiye katlandı.
Meningiomdan sonra en sık görülen ikinci merkezi sinir sistemi kanseridir . Erkeklerde kadınlardan daha sık görülür. Ortalama tanı yaşı 64 olmasına rağmen, 2014 yılında, geniş beyin kanserleri kategorisi, Amerika Birleşik Devletleri'nde 20 yaşın altındaki kişilerde yalnızca lösemiden sonra ikinci sıradaydı.
Tarih
Glioblastoma multiforme terimi 1926'da Percival Bailey ve Harvey Cushing tarafından tümörün glial hücrelerin ( glioblastlar ) ilkel öncülerinden kaynaklandığı ve nekroz, kanama ve kistlerin varlığından dolayı oldukça değişken görünüm olduğu fikrine dayanarak tanıtıldı. çok biçimli).
Araştırma
Gen tedavisi
Gen tedavisi , glioblastomayı tedavi etmek için bir yöntem olarak araştırılmıştır ve hayvan modelleri ve erken faz klinik deneyleri başarılı olurken, 2017 itibariyle, glioblastoma için faz III klinik deneylerinde test edilen tüm gen tedavisi ilaçları başarısız olmuştur. Bilim adamları, olumlu sonuçlarla etkili gen dağıtımı ve takibi için çekirdek-kabuk nanoyapılı LPLNP-PPT'yi geliştirdiler. Bu, kanser hücrelerinin, daha spesifik olarak glioblastomların apoptozunu indüklemek için kodlanmış bir TRAIL ligandıdır. Bu çalışma halen klinik deneylerde olmasına rağmen, tanısal ve terapötik işlevler göstermiştir ve kök hücre temelli tedavide klinik uygulamalara büyük ilgi gösterecektir.
onkolitik viroterapi
Onkolitik viroterapi , hem klinik öncesi hem de klinik aşamalarda araştırılmakta olan, gelişmekte olan yeni bir tedavidir. Herpes simpleks virüsü, adenovirüs, poliovirüs ve reovirüs dahil olmak üzere çeşitli virüsler, şu anda glioblastoma tedavisi için klinik denemelerin I. ve II. fazlarında test edilmektedir ve genel sağkalımı iyileştirdiği gösterilmiştir.
Burun içi ilaç dağıtımı
Burundan beyne doğrudan ilaç dağıtımı, beyinde daha yüksek ve umarız daha etkili ilaç konsantrasyonları elde etmenin bir yolu olarak araştırılmaktadır. Brezilya'daki glioblastoma hastalarıyla yapılan bir klinik faz I/II çalışması, bir aerosol olarak intranazal uygulama için doğal bileşik perilil alkolü araştırdı . Sonuçlar cesaret vericiydi ve 2016 itibariyle Amerika Birleşik Devletleri'nde benzer bir deneme başlatıldı.
Ayrıca bakınız
Referanslar
Dış bağlantılar
| sınıflandırma | |
|---|---|
| Dış kaynaklar |
- Amerikan Beyin Tümörü Derneği'nden Glioblastoma Multiforme (GBM) hakkında bilgi
- AFIP Kurs Müfredatı – Astrocytoma WHO Derecelendirme Ders Notu