Ekstrakorporeal membran oksijenasyonu - Extracorporeal membrane oxygenation
| Ekstrakorporeal membran oksijenasyonu | |
|---|---|
 | |
| Diğer isimler | Ekstrakorporeal yaşam desteği (ECLS) |
| ICD-10-PCS | 5A15223 |
| ICD-9-CM | 39.65 |
| ağ | 29295 |
| MedlinePlus | 007234 |
| HCPCS-L2 | 36822 |
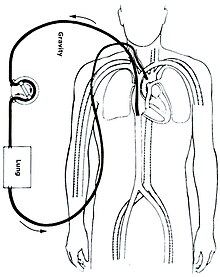
Ekstrakorporeal yaşam desteği ( ECLS ) olarak da bilinen ekstrakorporeal membran oksijenasyonu ( ECMO ), kalbi ve akciğerleri yaşamı sürdürmek için yeterli miktarda gaz değişimi veya perfüzyon sağlayamayan kişilere uzun süreli kalp ve solunum desteği sağlayan ekstrakorporeal bir tekniktir . ECMO teknolojisi büyük ölçüde , durdurulmuş doğal dolaşım ile daha kısa süreli destek sağlayan kardiyopulmoner baypastan türetilmiştir . Kullanılan cihaz , yapay akciğer olarak da bilinen bir membran oksijenatördür .
ECMO, kırmızı kan hücrelerinin yapay oksijenlenmesine ve karbondioksitin uzaklaştırılmasına izin vermek için vücuttan geçici olarak kan çekerek çalışır . Genel olarak, kardiyopulmoner baypas sonrası veya derin kalp ve/veya akciğer yetmezliği olan bir kişinin geç evre tedavisinde kullanılır, ancak şimdi belirli merkezlerde kalp durması için bir tedavi olarak kullanılmasına ve altta yatan nedenin tedavisine izin verilmesine rağmen. dolaşım ve oksijenasyon desteklenirken tutuklama. ECMO, yapay ventilasyonun kan oksijenasyon seviyelerini sürdürmek için tek başına yeterli olmadığı durumlarda COVID-19 ile ilişkili akut viral pnömonisi olan hastaları desteklemek için de kullanılır .
Tıbbi kullanımlar
ECMO'nun endikasyonlarını ve uygulamasını açıklayan kılavuzlar, Ekstrakorporeal Yaşam Destek Organizasyonu (ELSO) tarafından yayınlanmaktadır . ECMO'nun başlatılması için kriterler kuruma göre değişir, ancak genellikle potansiyel olarak geri döndürülebilir ve geleneksel tedaviye yanıt vermeyen akut şiddetli kardiyak veya pulmoner yetmezliği içerir. ECMO'nun başlatılmasını gerektirebilecek klinik durumlara örnekler aşağıdakileri içerir:
- İnspire edilen oksijen fraksiyonu (FiO2), pozitif ekspirasyon sonu basıncı (PEEP) dahil olmak üzere ventilatör ayarlarının optimizasyonuna rağmen , arteriyel oksijen geriliminin solunan oksijen fraksiyonuna (PaO2/FiO2) <100 mmHg oranıyla hipoksemik solunum yetmezliği , ve inspiratuar/ekspiratuar (I:E) oranı
- Arteriyel pH <7,20 olan hiperkapnik solunum yetmezliği
- Refrakter kardiyojenik şok
- Kalp durması
- Kardiyak cerrahi sonrası kardiyopulmoner baypastan ayrılamama
- Kalp transplantasyonuna veya ventriküler destek cihazının yerleştirilmesine köprü olarak
- Akciğer nakline köprü olarak
- Septik şok, ECMO'nun daha tartışmalı ancak giderek daha fazla çalışılan bir kullanımıdır.
- 28 ila 24 °C arasında bir çekirdek sıcaklığı ve kalp kararsızlığı veya 24 °C'nin altında bir çekirdek sıcaklığı ile hipotermi.
Kardiyak arrest veya kardiyojenik şoku olanlarda, sağkalımı ve iyi sonuçları iyileştirdiği görülmektedir.
COVID-19 hastalarında kullanım
Şubat 2020'nin başlarından itibaren, Çin'deki doktorlar, yalnızca ventilasyonla kan oksijenasyon seviyeleri hala devam ederken, SARS-CoV-2 enfeksiyonu ( COVID-19 ) ile ilişkili akut viral pnömoni ile başvuran hastalara ek destek olarak ECMO'yu giderek daha fazla kullanıyor. hastayı ayakta tutamayacak kadar düşük. İlk raporlar, hastaların kan oksijen doygunluğunu düzeltmeye ve kullanıldığı ciddi vakaların yaklaşık %3'ünde ölümleri azaltmaya yardımcı olduğunu gösteriyor. Kritik hastalar için, ölüm oranı geleneksel tedavi ile yaklaşık %59-71'den ekstrakorporeal membran oksijenasyonu ile yaklaşık %46'ya düşer. Bir Mart 2021 Los Angeles Times kapak hikayesi, ECMO'nun son derece zorlu bir COVID hastasında etkinliğini gösterdi. Şubat 2021'de, "çok ciddi" COVID-19 vakaları olan üç hamile İsrailli kadına ECMO tedavisi verildi ve bu tedavi seçeneği devam edecek gibi görünüyordu.
sonuçlar
Erken çalışmalar, özellikle akut solunum sıkıntısı sendromu durumunda akut solunum yetmezliği olan kişiler için ECMO kullanımı ile sağkalım yararı göstermiştir . ELSO tarafından tutulan ve ECMO alan yaklaşık 51.000 kişiden oluşan bir kayıt, yenidoğan solunum yetmezliği için %75 sağkalım, pediatrik solunum yetmezliği için %56 sağkalım ve yetişkin solunum yetmezliği için %55 sağkalım ile sonuçlar bildirmiştir. Diğer gözlemsel ve kontrolsüz klinik deneyler, hayatta kalma oranlarının %50 ila %70 arasında olduğunu bildirmiştir. Bu bildirilen hayatta kalma oranları, tarihsel hayatta kalma oranlarından daha iyidir. ECMO, değişen ölüm oranlarına sahip bir dizi koşul için kullanılsa da, erken teşhis, bozulmanın ilerlemesini önlemek ve hayatta kalma sonuçlarını artırmak için anahtardır.
In Birleşik Krallık , venovenöz ECMO dağıtım potansiyel bakımını iyileştirmek ve daha iyi sonuçlar teşvik etmek tayin ECMO merkezlerinde yoğunlaşmaktadır.
Kontrendikasyonlar
Çoğu kontrendikasyon görecelidir ve prosedürün riskleri ile potansiyel faydaları dengelenir. Göreceli kontrendikasyonlar şunlardır:
- Kişi iyileşirse normal yaşamla bağdaşmayan durumlar
- Yaşam kalitesini etkileyen önceden var olan durumlar ( MSS durumu, son dönem malignite, antikoagülasyon ile sistemik kanama riski)
- Yaş ve boyut
- Boşluk: Çok hasta olanlar, çok uzun süredir geleneksel tedavi görenler veya ölümcül bir teşhisi olanlar.
Yan etkiler/Komplikasyonlar
nörolojik
ECMO ile tedavi edilen yetişkinlerde yaygın bir sonuç, intraserebral kanama, subaraknoid kanama , beynin duyarlı bölgelerinde iskemik enfarktüsler, hipoksik-iskemik ensefalopati, açıklanamayan koma ve beyin ölümünü içerebilen nörolojik hasardır . ECMO alanların %30 ila %40'ında kanama meydana gelir ve hayatı tehdit edici olabilir. Hem gerekli sürekli heparin infüzyonu hem de trombosit fonksiyon bozukluğundan kaynaklanmaktadır. Titiz cerrahi teknik, muhafaza trombosit sayımı daha büyük / aa 100,000 3 ve hedef muhafaza süresi pıhtılaşma aktif kanama olasılığını azaltır.
Kan
ECMO alan kişilerde heparin kaynaklı trombositopeni (HIT) giderek yaygınlaşmaktadır. HIT'den şüphelenildiğinde, heparin infüzyonu genellikle heparin olmayan bir antikoagülan ile değiştirilir.
VA (Veno-Arteriyel) ECMO için femoral arter ve ven her kullanıldığında, inen aortta retrograd kan akışı vardır. Sol ventrikül çıkışı korunmazsa kanın durması meydana gelebilir ve bu da tromboza neden olabilir.
Cihaza yardımcı olmak için köprü
VA ECMO'da, kardiyak fonksiyonları ECMO'dan ayrılmak için yeterince iyileşmeyenler bir ventriküler destek cihazına (VAD) veya transplanta köprülenebilir. Kanülasyon sırasında kanamalı damar perforasyonu, arteriyel diseksiyon, distal iskemi ve yanlış yerleşim (örneğin arter içine yerleştirilmiş venöz kanül) dahil olmak üzere çeşitli komplikasyonlar ortaya çıkabilir, ancak bu olaylar çok seyrek olarak meydana gelir.
Çocuklar
Erken doğmuş bebekler, 32 haftadan küçük bir gebelik haftasında ECMO uygulandığında intraventriküler kanama (IVH) için kabul edilemez derecede yüksek risk altındadır .
Enfeksiyonlar
ECMO sırasında hastane kaynaklı enfeksiyonların prevalansı %10-12'dir (diğer kritik hastalara göre daha yüksektir). Koagülaz negatif stafilokoklar, Candida spp., Enterobacteriaceae ve Pseudomonas aeruginosa en sık tutulan patojenlerdir. ECMO hastaları, ana rolü Enterobacteriaceae'nin oynadığı yüksek bir ventilatör ilişkili pnömoni insidansı (24.4 vaka/1000 ECMO günü) sergilemektedir . Enfeksiyon gelişimi için en önemli risk faktörü olan ECMO çalışması süresi boyunca enfeksiyon riskinin arttığı gösterilmiştir. Enfeksiyonlara zemin hazırlayan diğer ECMO'ya özgü faktörler arasında, ECMO hastalarındaki hastalığın ciddiyeti, bağırsaktan bakteriyel translokasyon riskinin yüksek olması ve bağışıklık sisteminin ECMO ile ilişkili bozulması yer alır. Bir diğer önemli konu ise kateterlerin, ECMO kanüllerinin ve oksijenatörün mikrobiyal kolonizasyonudur.
Türler
ECMO'nun çeşitli biçimleri vardır; en yaygın ikisi veno-arteriyel (VA) ECMO ve veno-venöz (VV) ECMO'dur. Her iki yöntemde de venöz sistemden boşaltılan kan vücudun dışında oksijenlenir. VA ECMO'da bu kan arteriyel sisteme, VV ECMO'da ise kan venöz sisteme geri verilir . VV ECMO'da kardiyak destek sağlanmaz.
Veno-arteriyel
Veno-arteriyel (VA) ECMO olarak, bir venöz kanül genellikle sağ yerleştirilir ya da ortak sol femoral ven ekstraksiyonu için, bir arteryel kanül genellikle sağ yerleştirilir veya sola femoral arter infüzyon için. Femoral arter kanülünün ucu iliak arterde tutulurken , femoral ven kanülünün ucu inferior vena kava ile sağ atriyumun birleştiği yere yakın tutulmalıdır. Erişkinlerde, yerleştirme daha basit olduğu için femoral artere erişim tercih edilir. Kardiyopulmoner baypas zaten kurulmuşsa veya acil res-sternotomi uygulanmışsa (sağ atriyumda kanül (veya triküspit onarımı için SVC/IVC) ve çıkan aort ile) merkezi VA ECMO kullanılabilir.
VA ECMO tipik olarak, aort kanülü tarafından iletilen retrograd akışa karşı pompalama ile ilişkili artan kardiyak inme işini azaltmak için doğal kardiyak fonksiyon minimal olduğunda ayrılır.
veno-venöz
Veno-venöz (VV) ECMO'da kanüller genellikle drenaj için sağ ortak femoral vene ve infüzyon için sağ internal juguler vene yerleştirilir . Alternatif olarak, sağ iç juguler vene çift lümenli bir kateter yerleştirilir, üst ve alt vena kavadan kan akıtılır ve sağ atriyuma geri döndürülür.
başlatma
ECMO yalnızca başlatılması, sürdürülmesi ve sonlandırılması konusunda eğitim ve deneyime sahip klinisyenler tarafından gerçekleştirilmelidir. ECMO yerleştirme tipik olarak bir kardiyotorasik cerrah tarafından ameliyathane ortamında gerçekleştirilir . ECMO yönetimi genellikle kayıtlı bir hemşire, solunum terapisti veya bir perfüzyonist tarafından gerçekleştirilir. ECMO'nun başlatılmasına karar verildikten sonra , oksijenatörde trombüs oluşumunun pıhtılaşmasını önlemek için hastaya intravenöz heparin ile antikoagüle edilir . Başlamadan önce, aktif pıhtılaşma süresinin (ACT) 300 ila 350 saniye arasında olduğundan emin olmak için IV bolus heparin verilir ve ölçülür . ACT bu aralık arasında olduğunda, ECMO başlatılabilir ve ardından idame dozu olarak bir heparin damlası başlatılır.
kanülasyon
Kanüller , kan damarlarına erişim sağlamak için nispeten basit ve yaygın bir yöntem olan Seldinger tekniği veya cerrahi kesme yoluyla perkütan olarak yerleştirilebilir . Damarlara yerleştirilebilecek en büyük kanüller, akışı maksimuma çıkarmak ve kayma gerilimini minimuma indirmek için kullanılır.
Kardiyak cerrahi sonrası komplikasyonlar için gerekli olan ECMO, doğrudan kalbin veya büyük damarların uygun odacıklarına yerleştirilebilir. Lateral torakotomi yoluyla merkezi kanülasyon, akciğer nakli bekleyen hastaların sedasyonsuz ve ayaktan kalmalarını sağlar.
Titrasyon
Kanülasyon ve ECMO devresine bağlantının ardından, hemodinamik parametreler ve fizik muayene kullanılarak ECMO devresinden uygun kan akışı miktarı belirlenir. ECMO devresi yoluyla uç organ perfüzyonunu sürdürme hedefleri, stazı ve ardından kan pıhtısı oluşumunu önlemek için kalpten yeterli fizyolojik kan akışı ile dengelenir.
Bakım onarım
İlk solunum ve hemodinamik hedeflere ulaşıldığında, kan akışı bu hızda korunur. ECMO devresinin venöz kolundaki kanın oksihemoglobin satürasyonunu doğrudan ölçen sürekli venöz oksimetre ile sık değerlendirme ve ayarlamalar kolaylaştırılır.
Özel hususlar
VV ECMO tipik olarak solunum yetmezliği için kullanılırken VA ECMO kalp yetmezliği için kullanılır. Yönetimi etkileyen her bir ECMO türü için benzersiz hususlar vardır.
Kan akışı
Oksijen dağıtımını optimize etmek için VV ECMO sırasında genellikle maksimuma yakın akış hızları istenir. Buna karşılık, VA ECMO sırasında kullanılan akış hızı, yeterli perfüzyon basıncı ve venöz oksihemoglobin satürasyonu (drenaj kanında ölçülür) sağlamaya yetecek kadar yüksek, ancak sol ventrikül çıkışını sürdürmek için yeterli ön yük sağlamaya yetecek kadar düşük olmalıdır.
diürez
ECMO başlatıldığında çoğu insan aşırı sıvı yüklendiğinden , hasta ECMO'da stabil olduğunda agresif diürez garanti edilir. Hastanın yetersiz idrar çıkışı varsa, ECMO devresine kolayca ultrafiltrasyon eklenebilir. ECMO "gevezeliği" veya ECMO dalga formlarının kararsızlığı, yetersiz resüsitasyon anlamına gelir ve agresif diürez veya ultrafiltrasyonun kesilmesini destekler.
Sol ventrikül izleme
VA ECMO sırasında sol ventrikül çıkışı titizlikle izlenir, çünkü sol ventrikül işlevi artan art yükten bozulabilir ve bu da kalp içinde trombüs oluşumuna yol açabilir.
Sütten kesme ve sonlandırma
Solunum yetmezliği olanlar için, radyografik görünümdeki, pulmoner kompliyanstaki ve arteriyel oksihemoglobin satürasyonundaki gelişmeler, kişinin ECMO desteğinden alınmaya hazır olabileceğini gösterir. Kalp yetmezliği olanlar için, gelişmiş aort pulsatilitesi, gelişmiş sol ventrikül çıkışı ile ilişkilidir ve ECMO desteğinden ayrılmaya hazır olabileceklerini gösterir. Tüm belirteçler iyi durumdaysa, ECMO üzerindeki kan akışları yavaş yavaş azalacak ve bu süre zarfında hastanın değişiklikleri tolere edebilmesini sağlamak için hasta parametreleri gözlenecektir. Akımlar dakikada 2 litrenin altına düştüğünde kalıcı çıkarma denenir ve bu süre boyunca kanüller çıkarılıncaya kadar hasta izlenmeye devam edilir.
Veno-venöz ECMO kurtuluş denemesi
VV ECMO denemeleri, oksijenatör aracılığıyla tüm karşı akım süpürme gazını ortadan kaldırarak gerçekleştirilir. Ekstrakorporeal kan akımı sabit kalır, ancak gaz transferi gerçekleşmez. Ardından, ECMO'dan yeterli oksijenasyonu ve ventilasyonu korumak için gerekli olan ventilatör ayarlarının arteriyel ve venöz kan gazı sonuçlarıyla belirtildiği gibi belirlendiği birkaç saat boyunca gözlemlenirler.
Veno-arteriyel ECMO kurtuluş denemesi
VA ECMO denemeleri hem drenaj hem de infüzyon hatlarının geçici olarak klemplenmesini gerektirirken, ECMO devresinin arteriyel ve venöz uzuvlar arasında bir köprü üzerinden dolaşmasına izin verir. Bu , ECMO devresi içinde durgun kanın trombozunu önler . Ayrıca arteriyel ve venöz hatlar sürekli olarak heparinize salinle veya aralıklı olarak devreden heparinize kanla yıkanmalıdır. Genel olarak, VA ECMO denemelerinin süresi, daha yüksek trombüs oluşumu riski nedeniyle VV ECMO denemelerinden daha kısadır.
Tarih
ECMO 1950'lerde John Gibbon ve ardından C. Walton Lillehei tarafından geliştirildi . Yenidoğanlar için ilk kullanım 1965 yılında olmuştur.
Gray Lary'yi yasaklamak ilk olarak intravenöz oksijenin yaşamı sürdürebileceğini gösterdi. Sonuçları Kasım 1951'de Surgical Forum'da yayınlandı . Lary, 2007'deki bir sunumunda ilk çalışması hakkında şunları yazdı: "Araştırmamız, ilk kez, saf nitrojen solurken hayvanları canlı tutan bir aparatı monte ederek başladı. Bu, kan dolaşımına enjekte edilen çok küçük oksijen kabarcıkları ile gerçekleştirilir.Bu kabarcıklar, porselen bir filtreden venöz kan akışına zorlanan oksijene bir "ıslatıcı madde" eklenerek yapılmıştır.Amerikan Cerrahlar Koleji'ne ilk sunumundan kısa bir süre sonra, bu cihaz, DeWall ile bir bubble oksijenatör kullanan ilk pratik kalp akciğer makinesini yapan Walton Lillehei tarafından gözden geçirildi. Varyasyonlarla bu tür makineler sonraki yirmi yıl boyunca kullanıldı."
Toplum ve kültür
Üreticiler
-
 Medtronik
Medtronik
-
 Maket ( Getinge Grubu )
Maket ( Getinge Grubu ) -
 Xenios AG ( Fresenius Medical Care )
Xenios AG ( Fresenius Medical Care ) -
 Sorin Grubu
Sorin Grubu
-
 Terumo
Terumo
-
 Nipro
Nipro
-
 Mikro Bağlantı Noktası
Mikro Bağlantı Noktası
kullanılabilirlik
| ülke/bölge | Kıta | Hastaneler donanımlı | Birimler |
|---|---|---|---|
|
|
Kuzey Amerika | 264 (2019'da) | |
|
|
Kuzey Amerika | 19 (2020'de) | |
|
|
Okyanusya | 146 (2020'de) | |
|
|
Güney Amerika | 21 (2021'de) | |
|
|
Avrupa | 5 (2020'de) | 15 (2020'de) |
|
|
Avrupa | 0 (2020'de) | 0 (2020'de) |
|
|
Avrupa | 1 (2020'de) | 6 (2020'de) |
|
|
Avrupa | 214 (2020'de) | 755 (2020'de) |
|
|
Avrupa | 47 (2020'de) | |
|
|
Avrupa | 7 veya daha fazla (2020'de) | |
|
|
Avrupa | 0 (2020'de) | 0 (2020'de) |
|
|
Avrupa | 124 + 17 (2020'de) | |
|
|
Avrupa | 16 (2020'de) | |
|
|
Avrupa | 7 | 19 (2020'de) |
|
|
Asya | 2208 (2020'de) | |
|
|
Asya | 400 (yaklaşık 2020'de) | |
|
|
Asya | 51 (2016'da) | 105 (2016'da)
129 (2016'da kiralık birimler dahil) |
Araştırma
2014 yılında yapılan bir çalışma, faktör XIIa inhibitör antikorunun, kanama riskini artırmadan ekstrakorporeal dolaşımda tromboproteksiyon sağladığını göstermiştir. Neonatal hayvanlar üzerinde yapılan deneyler, ECMO tedavisinin enterositlerin apoptozisine , bağırsak mukozal bariyerinin zarar görmesine ve bakteriyel translokasyona yol açabileceğini göstermiştir . Bu, yenidoğanlarda sistemik inflamatuar yanıt sendromunun daha fazla ciddiyetini açıklayabilir. ECMO, nakledilen organların canlılık oranını artırabildiği için kadavralarda da kullanıldığını görmüştür .
Referanslar
Dış bağlantılar
| Scholia , Ekstrakorporeal membran oksijenasyonu için bir profile sahiptir (Q1385195) . |
- Amerikan Toraks Derneği , Hasta Eğitimi: ECMO Nedir? (Çevrimiçi-PDF)