Elektrik pili -Electric battery
 Çeşitli piller ve piller (sol üstten sağ alta): iki AA , bir D , bir el amatör radyo pili, iki 9 volt (PP3), iki AAA , bir C , bir video kamera pili, bir telsiz telefon pili
| |
| Tip | Güç kaynağı |
|---|---|
| Çalışma prensibi | Elektrokimyasal reaksiyonlar , Elektromotor kuvvet |
| İlk üretim | 1800'ler |
| elektronik sembol | |
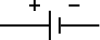 Devre şemasında bir pilin sembolü . En eski pil türü olan volta pilinin şematik bir çizimi olarak ortaya çıktı . | |
Bir elektrik pili , elektrikli cihazlara güç sağlamak için harici bağlantıları olan bir veya daha fazla elektrokimyasal hücreden oluşan bir elektrik güç kaynağıdır .
Bir pil güç sağladığında, artı ucu katottur ve eksi ucu anottur . Negatif işaretli terminal, harici bir elektrik devresinden pozitif terminale akacak olan elektronların kaynağıdır. Bir pil harici bir elektrik yüküne bağlandığında, bir redoks reaksiyonu yüksek enerjili reaktanları düşük enerjili ürünlere dönüştürür ve serbest enerji farkı dış devreye elektrik enerjisi olarak iletilir. Tarihsel olarak "pil" terimi, özellikle birden fazla hücreden oluşan bir cihaza atıfta bulunur; ancak kullanım, tek bir hücreden oluşan cihazları içerecek şekilde gelişti.
Birincil (tek kullanımlık veya "atılabilir") piller , elektrot malzemeleri deşarj sırasında geri döndürülemez şekilde değiştiğinden bir kez kullanılır ve atılır ; yaygın bir örnek, el fenerleri ve çok sayıda taşınabilir elektronik cihaz için kullanılan alkalin pildir . İkincil (şarj edilebilir) piller , uygulanan bir elektrik akımı kullanılarak birçok kez boşaltılabilir ve yeniden şarj edilebilir; elektrotların orijinal bileşimi ters akımla geri yüklenebilir. Örnekler arasında araçlarda kullanılan kurşun-asit piller ve dizüstü bilgisayarlar ve cep telefonları gibi taşınabilir elektronik cihazlarda kullanılan lityum-iyon piller sayılabilir .
Piller, işitme cihazlarına ve kol saatlerine güç sağlamak için kullanılan minyatür hücrelerden , telefon santralleri ve bilgisayar veri merkezleri için bekleme veya acil durum gücü sağlayan odaların boyutundaki devasa pil bankalarına kadar pek çok şekil ve boyutta gelir .
Piller, benzin gibi yaygın yakıtlardan çok daha düşük özgül enerjiye (birim kütle başına enerji) sahiptir . Otomobillerde bu, yanmalı motorlara kıyasla elektrik motorlarının elektrik enerjisini mekanik işe dönüştürmede daha yüksek verimliliğiyle bir şekilde dengeleniyor.
Tarih
Buluş
1930'larda Bağdat Müzesi ve Irak Eski Eserler Dairesi müdürü Wilhelm König , seramik kap, bakır ve demirden oluşan birinci yüzyıla ait bir cihaz olan Bağdat pilinin keşfedildiğini bildirdi . Onun varsayımı, elektrokaplama için kullanıldığıydı, ancak daha sonraki teoriler, bunun elektroterapi için kullanılan tıbbi bir cihaz olabileceğini öne sürdü .
Benjamin Franklin , "pil" terimini ilk kez 1749'da bir dizi bağlantılı Leyden kavanoz kondansatörü kullanarak elektrikle deneyler yaparken kullandı . Franklin, birlikte çalışan silahlar için askeri terimi kullanarak, bir dizi kavanozu "pil" olarak tanımladığı şeyde gruplandırdı. Tutma gemilerinin sayısını çarparak, daha güçlü bir yük depolanabilir ve boşaltma sırasında daha fazla güç mevcut olabilir.
İtalyan fizikçi Alessandro Volta , 1800'de ilk elektrokimyasal pil olan voltaik pili yaptı ve tanımladı . Bu, önemli bir süre boyunca sabit bir akım üretebilen, tuzlu suyla ıslatılmış kağıt disklerle ayrılmış bir bakır ve çinko levhalar yığınıydı. Volta, voltajın kimyasal reaksiyonlardan kaynaklandığını anlamadı. Michael Faraday'ın 1834'te gösterdiği gibi, hücrelerinin tükenmez bir enerji kaynağı olduğunu ve elektrotlardaki ilgili korozyon etkilerinin, çalışmalarının kaçınılmaz bir sonucu olmaktan çok sadece bir baş belası olduğunu düşündü .
İlk piller deneysel amaçlar için çok değerli olmasına rağmen, pratikte voltajları dalgalandı ve uzun bir süre boyunca büyük bir akım sağlayamadılar. 1836'da İngiliz kimyager John Frederic Daniell tarafından icat edilen Daniell hücresi , ilk pratik elektrik kaynağıydı, bir endüstri standardı haline geldi ve elektrikli telgraf ağları için bir güç kaynağı olarak yaygın bir şekilde benimsendi . İçinde sülfürik asit ve bir çinko elektrotla dolu sırsız toprak bir kabın daldırıldığı, bakır sülfat çözeltisiyle doldurulmuş bakır bir kaptan oluşuyordu.
Bu ıslak piller, doğru kullanılmadığı takdirde sızıntıya ve dökülmeye eğilimli sıvı elektrolitler kullanıyordu. Birçoğu, bileşenlerini tutmak için cam kavanozlar kullandı, bu da onları kırılgan ve potansiyel olarak tehlikeli hale getirdi. Bu özellikler, ıslak hücreleri taşınabilir cihazlar için uygun hale getirmedi. On dokuzuncu yüzyılın sonlarına doğru, sıvı elektroliti bir macunla değiştiren kuru pillerin icadı, taşınabilir elektrikli cihazları pratik hale getirdi.
Vakum tüplü cihazlardaki piller, tarihsel olarak "A" pili için (filamente güç sağlamak için) bir ıslak hücre ve "B" pili için (plaka voltajını sağlamak için) bir kuru hücre kullanıyordu.
Gelecek
2010 ve 2018 yılları arasında yıllık pil talebi %30 artarak 2018'de toplam 180 Gwh'ye ulaştı. İhtiyatlı bir şekilde, büyüme oranının tahmini %25'te kalması ve 2030'da talebin 2600 Gwh'ye ulaşması bekleniyor. maliyet düşüşlerinin talebi daha da artırarak 3562 GwH'ye kadar çıkması bekleniyor.
Elektrik pili endüstrisindeki bu yüksek büyüme oranının önemli nedenleri arasında, fosil yakıtla çalışan enerji kaynaklarından daha temiz, yenilenebilir kaynaklara doğru antropojenik iklim değişikliğine dayalı hareketlerle desteklenen ulaşımın elektrifikasyonu ve elektrik şebekelerinde büyük ölçekli dağıtım yer alıyor. ve daha katı emisyon rejimleri.
Bataryalı elektrikli araçlarda ( araçtan şebekeye ) ve evde enerji depolamada kullanılanlar gibi, akıllı ölçümlü ve talep yanıtı için akıllı şebekelere bağlanan dağıtılmış elektrikli bataryalar, akıllı güç kaynağı şebekelerinde aktif katılımcılardır. Kısmen kullanılmış pillerin kademeli kullanımı gibi yeni yeniden kullanım yöntemleri, elektrik pillerinin genel kullanımına katkıda bulunur, enerji depolama maliyetlerini düşürür ve ayrıca daha uzun ömür nedeniyle kirlilik/emisyon etkilerini azaltır. Akülerin kademeli kullanımında, akü kapasitesi genellikle 5-8 yıl hizmet verdikten sonra %80'in altına düşen araç elektrik aküleri , yedek kaynak olarak veya yenilenebilir enerji depolama sistemleri için yeniden kullanılır.
Şebeke ölçeğinde enerji depolama, şebekeden veya bir enerji santralinden enerji toplamak ve depolamak ve daha sonra gerektiğinde elektrik veya diğer şebeke hizmetlerini sağlamak için bu enerjiyi boşaltmak için büyük ölçekli pil kullanımını öngörür . Şebeke ölçeğinde enerji depolama (anahtar teslimi veya dağıtılmış), akıllı güç kaynağı şebekelerinin önemli bileşenleridir.
Kimya ve prensipler

Piller kimyasal enerjiyi doğrudan elektrik enerjisine dönüştürür . Birçok durumda salınan elektrik enerjisi, elektrokimyasal reaksiyona giren metallerin, oksitlerin veya moleküllerin kohezyon veya bağ enerjilerindeki farktır. Örneğin, geçiş metallerinin aksine d-elektron bağı ile stabilize edilmedikleri için yüksek enerjili metaller olan Zn veya Li'de enerji depolanabilir . Piller, enerjik olarak elverişli redoks reaksiyonunun yalnızca elektronlar devrenin dış kısmından geçtiğinde gerçekleşebilecek şekilde tasarlanmıştır.
Bir pil belirli sayıda voltaik hücreden oluşur . Her hücre, metal katyonları içeren iletken bir elektrolit ile seri olarak bağlanan iki yarım hücreden oluşur . Bir yarım hücre, elektrolit ve anyonların (negatif yüklü iyonlar) göç ettiği elektrot olan negatif elektrot içerir; diğer yarı hücre, katyonların (pozitif yüklü iyonlar ) göç ettiği elektrolit ve pozitif elektrot içerir. Katotta katyonlar indirgenir (elektronlar eklenir), anotta metal atomları oksitlenir (elektronlar çıkarılır). Bazı hücreler, her yarım hücre için farklı elektrolitler kullanır; daha sonra, elektrik devresini tamamlamak için iyonların yarı hücreler arasında akmasına izin verirken elektrolitlerin karışmasını önlemek için bir ayırıcı kullanılır.
Her yarım hücrenin bir standarda göre bir elektromotor kuvveti ( emf , volt olarak ölçülür) vardır . Hücrenin net emk'si, yarı hücrelerinin emf'leri arasındaki farktır. Böylece, eğer elektrotların emk'leri ve ise, o zaman net emk ; başka bir deyişle, net emf , yarı reaksiyonların indirgeme potansiyelleri arasındaki farktır .
Bir hücrenin terminalleri boyunca veya elektriksel itici güç , terminal voltajı (fark) olarak bilinir ve volt olarak ölçülür . Ne şarj ne de deşarj olan bir hücrenin terminal voltajına açık devre voltajı denir ve hücrenin emf'sine eşittir. İç direnç nedeniyle, boşalmakta olan bir hücrenin terminal voltajı, açık devre voltajından daha küçüktür ve şarj olan bir hücrenin terminal voltajı, açık devre voltajını aşmaktadır. İdeal bir hücre ihmal edilebilir bir iç dirence sahiptir, bu nedenle bitene kadar sabit bir terminal voltajını korur ve ardından sıfıra düşer. Böyle bir hücre 1,5 voltu muhafaza ederse ve bir kulonluk bir yük üretirse , o zaman tamamen boşaldığında 1,5 joule iş yapmış olur. Gerçek hücrelerde, deşarj altında iç direnç artar ve deşarj altında açık devre gerilimi de düşer. Gerilim ve direnç zamana karşı çizilirse, ortaya çıkan grafikler tipik olarak bir eğridir; eğrinin şekli, kullanılan kimyaya ve dahili düzenlemeye göre değişir.
Bir hücrenin terminallerinde geliştirilen voltaj , elektrotlarının ve elektrolitinin kimyasal reaksiyonlarının enerji salınımına bağlıdır. Alkalin ve çinko-karbon pillerin farklı kimyaları vardır, ancak yaklaşık olarak aynı emf 1,5 volttur; benzer şekilde NiCd ve NiMH hücrelerinin farklı kimyaları vardır, ancak yaklaşık olarak aynı emf 1,2 volttur. Lityum bileşiklerinin reaksiyonlarındaki yüksek elektrokimyasal potansiyel değişiklikleri, lityum hücrelere 3 volt veya daha fazla emf verir.
Elektriği iletmek için yeterli iyona sahip hemen hemen her sıvı veya nemli nesne, bir hücre için elektrolit görevi görebilir. Bir yenilik veya bilim gösterisi olarak, farklı metallerden yapılmış iki elektrotu bir limon , patates vb. İçine sokup az miktarda elektrik üretmek mümkündür.
İki madeni para (bir nikel ve bir kuruş gibi ) ve tuzlu suya batırılmış bir kağıt havlu parçasından bir volta yığını yapılabilir . Böyle bir yığın çok düşük bir voltaj üretir, ancak birçoğu seri olarak istiflendiğinde kısa bir süre için normal pillerin yerini alabilir.
Türler
Birincil ve ikincil piller

Piller birincil ve ikincil formlara ayrılır:
- Birincil piller, enerjileri bitene kadar kullanılmak ve sonra atılmak üzere tasarlanmıştır. Kimyasal reaksiyonları genellikle tersine çevrilemez, bu nedenle yeniden şarj edilemezler. Pildeki reaktanların kaynağı bittiğinde, pil akım üretmeyi durdurur ve işe yaramaz.
- İkincil piller şarj edilebilir; yani hücreye elektrik akımı uygulayarak kimyasal reaksiyonlarını tersine çevirebilirler . Bu, orijinal kimyasal reaktanları yeniden üretir, böylece birden çok kez kullanılabilir, yeniden şarj edilebilir ve tekrar kullanılabilirler.
Örneğin telgraf devreleri için kullanılan bazı birincil pil türleri, elektrotlar değiştirilerek çalışır duruma getirildi. İkincil piller, aktif maddelerin dağılması, elektrolit kaybı ve dahili korozyon nedeniyle süresiz olarak yeniden şarj edilemez.
Birincil piller veya birincil hücreler , montajdan hemen sonra akım üretebilir. Bunlar en yaygın olarak, düşük akım tahliyesine sahip, yalnızca aralıklı olarak kullanılan veya alternatif bir güç kaynağından oldukça uzakta kullanılan, örneğin diğer elektrik gücünün yalnızca aralıklı olarak mevcut olduğu alarm ve iletişim devrelerinde kullanılan taşınabilir cihazlarda kullanılır. Tek kullanımlık birincil hücreler, kimyasal reaksiyonlar kolayca tersine çevrilemediğinden ve aktif maddeler orijinal biçimlerine geri dönemeyebileceğinden güvenilir bir şekilde yeniden doldurulamaz. Pil üreticileri, birincil hücreleri yeniden şarj etmeye çalışmamanızı önerir. Genel olarak, bunlar şarj edilebilir pillerden daha yüksek enerji yoğunluklarına sahiptir, ancak tek kullanımlık piller, 75 ohm'un (75 Ω) altındaki yüklerle yüksek enerji tüketen uygulamalarda pek başarılı olmaz. Tek kullanımlık pillerin yaygın türleri arasında çinko-karbon piller ve alkalin piller bulunur .
İkincil piller veya şarj edilebilir piller olarak da bilinen ikincil piller , ilk kullanımdan önce şarj edilmelidir; genellikle boşalmış durumdaki aktif malzemelerle birleştirilirler. Şarj edilebilir piller, deşarj/kullanım sırasında meydana gelen kimyasal reaksiyonları tersine çeviren elektrik akımı uygulanarak (yeniden) şarj edilir. Uygun akımı sağlayan cihazlara şarj cihazları denir. Şarj edilebilir pillerin en eski biçimi, otomotiv ve teknecilik uygulamalarında yaygın olarak kullanılan kurşun-asit pildir . Bu teknoloji, sızdırmaz bir kapta sıvı elektrolit içerir ve aşırı şarj sırasında ürettiği hidrojen gazının güvenli bir şekilde dağılmasını sağlamak için akünün dik tutulmasını ve alanın iyi havalandırılmasını gerektirir . Kurşun asitli akü, sağlayabileceği elektrik enerjisi miktarına göre nispeten ağırdır. Düşük üretim maliyeti ve yüksek ani akım seviyeleri, kapasitesinin (yaklaşık 10 Ah'nin üzerinde) ağırlık ve kullanım sorunlarından daha önemli olduğu yerlerde onu yaygın hale getirir. Yaygın bir uygulama, genel olarak 450 amperlik bir tepe akımı sağlayabilen modern araba aküsüdür .
Kompozisyon
Galvanik hücreler , elektrolitik hücreler , yakıt hücreleri , akış hücreleri ve voltaik yığınlar dahil olmak üzere çeşitli kimyasal süreçler ve tasarımlarla birçok elektrokimyasal hücre türü üretilmiştir .
Islak pilde sıvı elektrolit bulunur . Diğer isimler , sıvı tüm iç parçaları kapladığından veya havalandırmalı hücre olduğundan, çalışma sırasında üretilen gazlar havaya kaçabileceği için taşmalı hücredir . Islak hücreler, kuru hücrelerin habercisiydi ve genellikle elektrokimya için bir öğrenme aracı olarak kullanılır . Elektrokimyasal hücrelerin nasıl çalıştığının gösterilmesi için beher gibi yaygın laboratuvar malzemeleriyle yapılabilirler . Konsantrasyon hücresi olarak bilinen belirli bir ıslak hücre tipi, korozyonun anlaşılmasında önemlidir . Islak hücreler, birincil hücreler (yeniden doldurulamayan) veya ikincil hücreler (yeniden doldurulabilen) olabilir. Başlangıçta, Daniell hücresi gibi tüm pratik birincil piller, üstü açık cam kavanoz ıslak piller olarak yapıldı. Diğer birincil ıslak hücreler, Leclanche hücresi , Grove hücresi , Bunsen hücresi , Kromik asit hücresi , Clark hücresi ve Weston hücresidir . Leclanche hücre kimyası ilk kuru hücrelere uyarlandı. Islak hücreler hala otomobil akülerinde ve endüstride anahtarlama cihazları , telekomünikasyon veya büyük kesintisiz güç kaynakları için yedek güç olarak kullanılmaktadır , ancak birçok yerde bunun yerine jel hücreli aküler kullanılmıştır. Bu uygulamalar genellikle kurşun-asit veya nikel-kadmiyum hücreleri kullanır. Erimiş tuz pilleri , elektrolit olarak erimiş tuz kullanan birincil veya ikincil pillerdir. Yüksek sıcaklıklarda çalışırlar ve ısıyı korumak için iyi yalıtılmaları gerekir.
Bir kuru hücre , yalnızca akımın akmasına izin verecek kadar neme sahip bir macun elektrolit kullanır. Islak hücreden farklı olarak kuru pil, serbest sıvı içermediğinden, taşınabilir ekipman için uygun hale getirdiğinden, dökülmeden herhangi bir yönde çalışabilir. Karşılaştırıldığında, ilk ıslak hücreler tipik olarak açık üstten sarkan kurşun çubuklara sahip kırılgan cam kaplardı ve dökülmeyi önlemek için dikkatli bir şekilde ele alınması gerekiyordu. Kurşun-asit aküler, jel akünün geliştirilmesine kadar kuru pilin güvenliğini ve taşınabilirliğini sağlayamadı . Yaygın bir kuru hücre , bazen kuru Leclanché hücresi olarak adlandırılan, nominal voltajı 1,5 volt olan çinko-karbon pilidir, alkalin pille aynıdır (çünkü her ikisi de aynı çinko - manganez dioksit kombinasyonunu kullanır). Standart bir kuru pil, merkezi bir çubuk biçiminde bir karbon katodu olan, genellikle silindirik bir kap biçiminde bir çinko anot içerir. Elektrolit, çinko anodun yanında macun formundaki amonyum klorürdür . Elektrolit ve karbon katot arasında kalan boşluk, amonyum klorür ve manganez dioksitten oluşan ikinci bir macun tarafından alınır, ikincisi bir depolarizatör görevi görür . Bazı tasarımlarda amonyum klorür yerine çinko klorür kullanılır .
Bir yedek pil uzun süre (belki yıllarca) monte edilmeden (etkinleştirilmeden ve güç sağlamadan) saklanabilir. Aküye ihtiyaç duyulduğunda monte edilir (örn. elektrolit eklenerek); monte edildikten sonra pil şarj edilir ve çalışmaya hazırdır. Örneğin, bir elektronik topçu fünyesi için bir pil, bir silahın ateşlenmesiyle etkinleştirilebilir. İvme, pili harekete geçiren ve fünye devrelerine güç sağlayan bir elektrolit kapsülünü kırar. Yedek piller genellikle uzun süreli depolamadan (yıllar) sonra kısa bir hizmet ömrü (saniyeler veya dakikalar) için tasarlanır. Oşinografik aletler veya askeri uygulamalar için suyla etkinleştirilen bir pil , suya daldırıldığında etkinleştirilir.
28 Şubat 2017'de Austin'deki Texas Üniversitesi, lityum iyon pil mucidi John Goodenough liderliğindeki bir ekip tarafından geliştirilen yeni bir tür katı hal pil hakkında bir basın açıklaması yayınladı , "bu, daha güvenli, daha hızlı şarja yol açabilir, elde taşınan mobil cihazlar, elektrikli arabalar ve sabit enerji depolama için daha uzun ömürlü şarj edilebilir piller". Katı hal pilinin ayrıca "üç kat daha fazla enerji yoğunluğuna" sahip olduğu ve örneğin elektrikli araçlarda kullanım ömrünü artırdığı söyleniyor. Teknoloji, deniz suyundan çıkarılan sodyum gibi daha ucuz, dünya dostu malzemeler kullandığından, aynı zamanda daha ekolojik olarak sağlam olmalıdır. Ayrıca çok daha uzun ömürlüdürler.
Sony , canlı organizmalarda gözlemlenen süreçlere benzer şekilde şekerden elektrik üreten biyolojik bir pil geliştirdi . Pil, karbonhidratları parçalayan enzimlerin kullanımıyla elektrik üretir.
Sızdırmaz valf ayarlı kurşun-asit akü (VRLA akü), otomotiv endüstrisinde kurşun-asit ıslak hücrenin yerine geçmesiyle popülerdir. VRLA pili , sızıntı olasılığını azaltan ve raf ömrünü uzatan hareketsizleştirilmiş bir sülfürik asit elektroliti kullanır . VRLA pilleri elektroliti hareketsiz hale getirir. İki tür:
- Jel piller (veya "jel hücre") yarı katı bir elektrolit kullanır.
- Emilmiş Cam Mat (AGM) aküler, elektroliti özel bir cam elyafı mat içinde emer.
Diğer taşınabilir şarj edilebilir piller, cep telefonları ve dizüstü bilgisayarlar gibi uygulamalarda kullanışlı olan birkaç kapalı "kuru pil" tipini içerir . Bu tür piller (artan güç yoğunluğu ve maliyet sırasına göre) nikel-kadmiyum (NiCd), nikel-çinko (NiZn), nikel metal hidrit (NiMH) ve lityum-iyon (Li-iyon) hücreleri içerir. Li-ion, kuru pil şarj edilebilir pazarında açık ara en yüksek paya sahiptir. NiMH, daha yüksek kapasitesi nedeniyle çoğu uygulamada NiCd'nin yerini almıştır, ancak NiCd elektrikli aletler , iki yönlü telsizler ve tıbbi ekipmanlarda kullanılmaya devam etmektedir .
2000'li yıllardaki gelişmeler arasında , bir AA pilin bir USB konektörü aracılığıyla şarj edilmesini sağlayan USBCELL gibi yerleşik elektroniklere sahip piller, mevcut pillerden yaklaşık 100 kat daha fazla deşarj oranına izin veren nano piller ve şarj durumu olan akıllı pil paketleri yer alıyor. aşırı deşarj durumunda hasarı önleyen monitörler ve pil koruma devreleri. Düşük kendi kendine deşarj (LSD), ikincil hücrelerin nakliyeden önce şarj edilmesini sağlar.
Güneş enerjili en uzun ve en yüksek uçuşta lityum-kükürt piller kullanıldı.
Tüketici ve endüstriyel sınıflar
Her türden pil, tüketici ve endüstriyel sınıflarda üretilir. Daha pahalı endüstriyel sınıf piller, daha yüksek güç-boyut oranı sağlayan, daha düşük kendi kendine deşarj olan ve dolayısıyla kullanılmadığında daha uzun ömürlü, sızıntıya karşı daha fazla dirençli ve örneğin yüksek sıcaklık ve nemi kaldırabilen kimyaları kullanabilir. tıbbi otoklav sterilizasyonu ile.
Kombinasyon ve yönetim
Standart biçimli piller, onları kullanan cihazdaki pil yuvasına takılır. Bir cihaz standart biçimli piller kullanmadığında, pil yönetim sistemi ve içindeki pillerin eşit şekilde şarj edilmesini ve boşalmasını sağlayan pil izolatörü gibi özelliklere ek olarak, bunlar genellikle birden çok pili tutan özel bir pil takımında birleştirilir.
Boyutlar
Tüketicilerin kolayca bulabileceği birincil piller, elektrikli saatler için kullanılan küçük düğme pillerden , sinyal devreleri veya diğer uzun süreli uygulamalar için kullanılan 6 numaralı pillere kadar çeşitlilik gösterir. İkincil hücreler çok büyük boyutlarda yapılır; çok büyük piller bir denizaltıya güç sağlayabilir veya bir elektrik şebekesini stabilize edebilir ve tepe yüklerin dengelenmesine yardımcı olabilir.
2017 itibariyle, dünyanın en büyük pili Tesla tarafından Güney Avustralya'da üretildi . 129 MWh depolayabilir. Çin'in Hebei Eyaletinde 36 MWh elektrik depolayabilen bir pil, 2013 yılında 500 milyon dolara mal oldu. Ni-Cd hücrelerinden oluşan bir başka büyük pil Alaska, Fairbanks'teydi . Bir futbol sahasından daha büyük olan 2.000 metrekarelik (22.000 fit kare) bir alanı kaplıyordu ve 1.300 ton ağırlığındaydı. Elektrik kesintisi durumunda yedek güç sağlamak için ABB tarafından üretilmiştir . Pil, yedi dakikaya kadar 40 MW güç sağlayabilir. Rüzgar enerjisini depolamak için sodyum kükürt pilleri kullanılmıştır . 25 dakikada 11 MW sağlayabilen 4,4 MWh pil sistemi, Hawaii'deki Auwahi rüzgar çiftliğinin çıkışını stabilize ediyor.
Karşılaştırmak
Voltaj, enerji yoğunluğu, yanıcılık, mevcut hücre yapıları, çalışma sıcaklığı aralığı ve raf ömrü gibi birçok önemli hücre özelliği pil kimyası tarafından belirlenir.
| Kimya | anot (-) | katot (+) | Maks. voltaj, teorik (V) | Nominal gerilim, pratik (V) | Spesifik enerji (kJ/kg) | detaylandırma | 25 °C'de raf ömrü, %80 kapasite (ay) |
|---|---|---|---|---|---|---|---|
| çinko-karbon | Zn | C | 1.6 | 1.2 | 130 | Ucuz. | 18 |
| Çinko Klorür | 1.5 | "Ağır hizmet" olarak da bilinir, ucuzdur. | |||||
| Alkali (çinko-mangan dioksit) | Zn | MnO2 _ | 1.5 | 1.15 | 400-590 | Orta enerji yoğunluğu. Yüksek ve düşük drenajlı kullanımlar için iyidir. | 30 |
| Nikel oksihidroksit (çinko-mangan dioksit/nikel oksihidroksit) | 1.7 | Orta enerji yoğunluğu. Yüksek drenajlı kullanımlar için iyidir. | |||||
| Lityum (lityum-bakır oksit) Li–CuO | Li | CuO | 1.7 | Artık üretilmiyor. Gümüş oksit ( IEC tipi "SR") pillerle değiştirildi. | |||
| Lityum (lityum-demir disülfür) Ömür 2 | Li | FeS 2 | 1.8 | 1.5 | 1070 | Masraflı. 'artı' veya 'ekstra' pillerde kullanılır. | 337 |
| Lityum (lityum-mangan dioksit) LiMnO 2 | Li | MnO2 _ | 3.0 | 830–1010 | Masraflı. Sadece yüksek drenajlı cihazlarda veya çok düşük kendi kendine deşarj oranı nedeniyle uzun raf ömrü için kullanılır. Tek başına 'Lityum' genellikle bu tür kimyayı ifade eder. | ||
| Lityum (lityum–karbon florür) Li–(CF) n | Li | (CF) n | 3.6 | 3.0 | 120 | ||
| Lityum (lityum–krom oksit) Li–CrO 2 | Li | CRO2 _ | 3.8 | 3.0 | 108 | ||
| Lityum ( lityum-silikon ) | Li 22 Si 5 | ||||||
| cıva oksit | Zn | HgO | 1.34 | 1.2 | Yüksek drenaj ve sabit voltaj. Çoğu ülkede sağlık endişeleri nedeniyle yasaklanmıştır. | 36 | |
| çinko-hava | Zn | Ç 2 | 1.6 | 1.1 | 1590 | Daha çok işitme cihazlarında kullanılır. | |
| Zamboni yığını | Zn | Ag veya Au | 0.8 | Çok uzun ömür. Çok düşük (nanoamp, nA) akım | >2.000 | ||
| Gümüş oksit (gümüş-çinko) | Zn | ağ20 _ _ | 1.85 | 1.5 | 470 | Çok pahalı. Yalnızca ticari olarak 'düğme' hücrelerde kullanılır. | 30 |
| Magnezyum | Mg | MnO2 _ | 2.0 | 1.5 | 40 |
| Kimya | Hücre gerilimi | Spesifik enerji (kJ/kg) | Enerji yoğunluğu (kJ/litre) | Yorumlar |
|---|---|---|---|---|
| NiCd | 1.2 | 140 | Ucuz. Yüksek/düşük akış, orta düzeyde enerji yoğunluğu. Neredeyse hiç kapasite kaybı olmadan çok yüksek deşarj oranlarına dayanabilir. Orta derecede kendi kendine deşarj oranı. Kadmiyum nedeniyle çevresel tehlike, kullanımı artık Avrupa'da neredeyse yasaklanmıştır. | |
| kurşun-asit | 2.1 | 140 | Orta derecede pahalı. Orta enerji yoğunluğu. Orta derecede kendi kendine deşarj oranı. Daha yüksek deşarj oranları önemli ölçüde kapasite kaybına neden olur. Kurşun nedeniyle çevresel tehlike. Yaygın kullanım: otomobil aküleri | |
| NiMH | 1.2 | 360 | Ucuz. Daha yüksek enerji tüketen cihazlarda alkalin pillerden daha iyi performans gösterir. Geleneksel kimya, yüksek enerji yoğunluğuna sahiptir, ancak aynı zamanda yüksek bir kendi kendine deşarj oranına sahiptir. Daha yeni kimya düşük kendi kendine boşalma oranına sahiptir , ancak aynı zamanda ~%25 daha düşük enerji yoğunluğuna sahiptir. Bazı arabalarda kullanılır. |
|
| NiZn | 1.6 | 360 | Orta derecede ucuz. Yüksek drenaj cihazı uygundur. Düşük kendi kendine deşarj oranı. Voltaj, diğer ikincil hücrelere göre alkalin birincil hücrelere daha yakındır. Toksik bileşen yok. Pazara yeni tanıtıldı (2009). Henüz bir sicili oluşturmadı. Sınırlı boyut kullanılabilirliği. | |
| AgZn | 1,86 1,5 | 460 | Eşdeğer Li-ion'dan daha küçük hacim. Gümüş nedeniyle son derece pahalı. Çok yüksek enerji yoğunluğu. Çok yüksek tahliye kabiliyeti. Yüksek gümüş fiyatları nedeniyle uzun yıllar modası geçmiş kabul edildi. Hücre kullanılmadığı takdirde oksidasyona uğrar. Tepkiler tam olarak anlaşılmamıştır. Terminal voltajı çok kararlı ancak %70-80 şarjda aniden 1,5 volta düşüyor (pozitif plakada hem arjantlı hem de arjantik oksit bulunmasından kaynaklandığına inanılıyor; önce biri tüketiliyor). Birincil pil (moon buggy) yerine kullanılmıştır. Li-ion'un yerini alacak şekilde bir kez daha geliştiriliyor. | |
| LiFePO 4 | 3.3 3.0 | 360 | 790 | Lityum-Demir-Fosfat kimyası. |
| lityum iyon | 3.6 | 460 | Çok pahalı. Çok yüksek enerji yoğunluğu. Genellikle "yaygın" pil boyutlarında bulunmaz. Lityum polimer pil , dizüstü bilgisayarlarda, dijital kameralarda, video kameralarda ve cep telefonlarında yaygındır. Çok düşük kendi kendine deşarj oranı. Boşaltma sırasında terminal voltajı 4,2 ila 3,0 volt arasında değişir. Uçucu: Kısa devre yapılırsa, aşırı ısınmasına izin verilirse veya katı kalite standartlarıyla üretilmezse patlama olasılığı vardır. |
Performans, kapasite ve deşarj
Bir pilin özellikleri, dahili kimya, akım boşaltma ve sıcaklık gibi birçok faktör nedeniyle yük döngüsü, aşırı şarj döngüsü ve kullanım ömrü boyunca değişiklik gösterebilir . Düşük sıcaklıklarda, bir pil çok fazla güç sağlayamaz. Bu nedenle, soğuk iklimlerde bazı araç sahipleri, araç aküsünü sıcak tutan küçük elektrikli ısıtma yastıkları olan akü ısıtıcıları takar.
Bir pilin kapasitesi , anma geriliminde sağlayabileceği elektrik yükü miktarıdır . Hücrede ne kadar çok elektrot malzemesi bulunursa, kapasitesi o kadar artar. Küçük bir hücre, aynı açık devre voltajını geliştirmelerine rağmen, aynı kimyaya sahip daha büyük bir hücreden daha az kapasiteye sahiptir. Kapasite amper-saat (A·h) gibi birimlerle ölçülür . Bir pilin nominal kapasitesi, genellikle 20 saatin yeni bir pilin hücre başına belirli bir terminal voltajının üzerinde kalırken 20 saat boyunca 68 °F (20 °C) sağlayabildiği akımla çarpımı olarak ifade edilir. Örneğin, 100 A·h değerindeki bir pil, oda sıcaklığında 20 saatlik bir süre boyunca 5 A sağlayabilir . Bir pilin sağlayabileceği depolanan şarj oranı, pil kimyası, şarjın iletilme hızı (akım), gerekli terminal voltajı, depolama süresi, ortam sıcaklığı ve diğer faktörler dahil olmak üzere birçok faktöre bağlıdır.
Deşarj oranı ne kadar yüksek olursa, kapasite o kadar düşük olur. Bir kurşun asit batarya için akım, deşarj süresi ve kapasite arasındaki ilişki, Peukert yasası ile (tipik bir akım değerleri aralığında) yaklaşık olarak hesaplanır :
nerede
- 1 amper oranında deşarj edildiğinde kapasitedir.
- aküden çekilen akımdır ( A ).
- pilin dayanabileceği süredir (saat olarak).
- 1.3 civarında bir sabittir.
Uzun süre depolanan veya kapasitesinin küçük bir kısmında deşarj olan piller, akım üretmeden yük taşıyıcılarını tüketen genellikle geri dönüşü olmayan yan reaksiyonların varlığından dolayı kapasitelerini kaybederler. Bu fenomen dahili kendi kendine deşarj olarak bilinir. Ayrıca, piller yeniden şarj edildiğinde, sonraki deşarjlar için kapasiteyi azaltan ek yan reaksiyonlar meydana gelebilir. Yeterli yeniden şarjdan sonra, özünde tüm kapasite kaybolur ve pil güç üretmeyi durdurur. Dahili enerji kayıpları ve iyonların elektrolitten geçme hızındaki sınırlamalar, pil verimliliğinin değişmesine neden olur. Minimum bir eşiğin üzerinde, düşük hızda boşaltma, daha yüksek bir hızda olduğundan daha fazla pil kapasitesi sağlar. Farklı A·h değerlerine sahip pillerin takılması, yük limitleri aşılmadığı sürece belirli bir voltaj için derecelendirilmiş cihazın çalışmasını etkilemez (ancak çalışma aralığını etkileyebilir). Dijital kameralar gibi yüksek enerji tüketen yükler , alkalin pillerde olduğu gibi toplam kapasiteyi azaltabilir. Örneğin, 10 veya 20 saatlik deşarj için 2 A·h olarak derecelendirilmiş bir pil, belirtilen kapasitesinin ima ettiği gibi tam iki saat boyunca 1 A'lık bir akımı sürdüremez.
C oranı , bir pilin şarj edilme veya boşalma hızının bir ölçüsüdür. Bataryadan geçen akımın, bataryanın nominal nominal kapasitesini bir saat içinde teslim edeceği teorik akım çekişine bölümü olarak tanımlanır. h −1 birimlerine sahiptir . Dahili direnç kaybı ve hücrelerin içindeki kimyasal işlemler nedeniyle, bir pil etiketinde belirtilen kapasiteyi nadiren yalnızca bir saat içinde verir. Tipik olarak, maksimum kapasite düşük bir C oranında bulunur ve daha yüksek bir C oranında şarj etme veya boşaltma, bir pilin kullanılabilir ömrünü ve kapasitesini azaltır. Üreticiler genellikle kapasiteye karşı C oranı eğrilerini gösteren grafikler içeren veri sayfaları yayınlar. C oranı, bir pilin bir devrede güvenli bir şekilde iletebileceği maksimum akımı belirtmek için pillerde bir derecelendirme olarak da kullanılır. Şarj edilebilir piller için standartlar genellikle kapasiteyi ve şarj döngülerini 4 saatlik (0,25C), 8 saatlik (0,125C) veya daha uzun deşarj süresi üzerinden derecelendirir. Bilgisayar kesintisiz güç kaynağı gibi özel amaçlara yönelik türler, üreticiler tarafından bir saatten (1C) çok daha kısa deşarj süreleri için derecelendirilebilir, ancak sınırlı çevrim ömrüne sahip olabilirler.
2012 itibariyle, lityum demir fosfat ( LiFePO
4) pil teknolojisi en hızlı şarj/deşarj oldu ve 10-20 saniyede tamamen boşaldı.
Ömür
Pil ömrü (ve eşanlamlısı pil ömrü) şarj edilebilir piller için iki anlama gelirken şarj edilemeyen piller için yalnızca bir anlama gelir. Şarj edilebilirler için, bir cihazın tamamen şarj edilmiş bir pille çalışabileceği sürenin uzunluğu veya hücreler tatmin edici bir şekilde çalışmadan önce mümkün olan şarj/deşarj döngülerinin sayısı anlamına gelebilir. Şarj edilemeyen bir pil için bu iki ömür eşittir, çünkü hücreler tanım gereği yalnızca bir döngü sürer. (Raf ömrü terimi, bir pilin üretim ve kullanım arasında performansını ne kadar süre koruyacağını açıklamak için kullanılır.) Tüm pillerin kullanılabilir kapasitesi, azalan sıcaklıkla birlikte düşer. Günümüz pillerinin çoğunun aksine, 1812'de icat edilen Zamboni pili , yalnızca nanoamp aralığında akım sağlamasına rağmen, yenileme veya şarj gerektirmeden çok uzun bir kullanım ömrü sunar. Oxford Electric Bell , Zamboni yığınları olduğu düşünülen orijinal pil çiftiyle 1840'tan beri neredeyse sürekli çalıyor.
Tek kullanımlık piller, oda sıcaklığında (20–30 °C) saklandığında tipik olarak yılda orijinal şarjlarının yüzde 8 ila 20'sini kaybeder. Bu, "kendi kendine deşarj" oranı olarak bilinir ve hiçbir yük uygulanmadığında bile hücre içinde meydana gelen, akım üretmeyen "yan" kimyasal reaksiyonlardan kaynaklanır. Bazıları donarak zarar görse de, daha düşük sıcaklıklarda saklanan piller için yan reaksiyonların oranı azalır. Eski şarj edilebilir piller, tek kullanımlık alkalin pillerden, özellikle nikel bazlı pillerden daha hızlı kendi kendine boşalır; yeni şarj edilmiş bir nikel kadmiyum (NiCd) pil ilk 24 saatte şarjının %10'unu kaybeder ve ardından ayda yaklaşık %10 oranında boşalır. Bununla birlikte, daha yeni düşük kendi kendine deşarj olan nikel metal hidrit (NiMH) piller ve modern lityum tasarımları daha düşük bir kendi kendine boşalma oranı gösterir (ancak yine de birincil pillerden daha yüksektir).
Akü plakalarındaki aktif madde, her şarj ve deşarj döngüsünde kimyasal bileşimi değiştirir; Hacimdeki fiziksel değişiklikler nedeniyle aktif malzeme kaybolabilir, bu da pilin yeniden şarj edilme sayısını daha da sınırlar. Nikel bazlı pillerin çoğu satın alındığında kısmen boşalmıştır ve ilk kullanımdan önce şarj edilmelidir. Daha yeni NiMH piller satın alındığında kullanıma hazırdır ve yılda yalnızca %15 boşalırlar.
Her şarj-deşarj döngüsünde bir miktar bozulma meydana gelir. Bozulma genellikle elektrolitin elektrotlardan uzaklaşması veya aktif maddenin elektrotlardan ayrılması nedeniyle meydana gelir. Düşük kapasiteli NiMH piller (1.700–2.000 mA·h) yaklaşık 1.000 kez şarj edilebilirken, yüksek kapasiteli NiMH piller (2.500 mA·h'in üzerinde) yaklaşık 500 döngü sürer. NiCd piller, iç dirençleri kalıcı olarak kullanılabilir değerlerin üzerine çıkmadan önce 1.000 döngü için derecelendirilmiş olma eğilimindedir. Hızlı şarj, bileşen değişikliklerini artırarak pil ömrünü kısaltır. Bir şarj cihazı, pilin tam olarak ne zaman şarj edildiğini algılayamazsa, aşırı şarj olması muhtemeldir ve pil zarar görebilir.
NiCd hücreleri, belirli bir tekrarlayıcı şekilde kullanılırsa, " hafıza etkisi " adı verilen bir kapasite düşüşü gösterebilir . Etkisi basit uygulamalarla önlenebilir. NiMH hücreleri, kimyada benzer olmasına rağmen, hafıza etkisinden daha az muzdariptir.
Otomotiv kurşun-asit şarj edilebilir pilleri, titreşim, şok ve sıcaklık aralığı nedeniyle strese dayanmalıdır. Kurşun levhalarındaki bu gerilimler ve sülfatlanma nedeniyle, çok az otomotiv aküsü normal kullanımda altı yıldan fazla dayanır. Otomotiv çalıştırma ( SLI : Başlatma, Aydınlatma, Ateşleme ) pilleri, akımı en üst düzeye çıkarmak için birçok ince plakaya sahiptir. Genel olarak, plakalar ne kadar kalınsa ömür o kadar uzun olur. Tipik olarak yeniden şarj edilmeden önce yalnızca biraz boşalırlar. Elektrikli golf arabalarında kullanılanlar gibi "derin döngülü" kurşun asitli aküler, kullanım ömrünü uzatmak için çok daha kalın plakalara sahiptir. Kurşun asitli akünün ana faydası düşük maliyetli olmasıdır; ana dezavantajları, belirli bir kapasite ve voltaj için büyük boyutu ve ağırlığıdır. Kurşun asitli aküler asla kapasitelerinin %20'sinin altına boşaltılmamalıdır, çünkü yeniden şarj edildiklerinde dahili direnç ısınmaya ve hasara neden olur. Derin döngülü kurşun-asit sistemleri, pilin ömrünü kısaltacak türden hasarları önlemek için genellikle düşük şarjlı bir uyarı ışığı veya düşük şarjlı bir güç kesme anahtarı kullanır.
Pillerin buzdolabında veya derin dondurucuda olduğu gibi yan reaksiyonları yavaşlatan düşük sıcaklıkta saklanmasıyla pil ömrü uzatılabilir . Bu tür depolama, alkalin pillerin ömrünü yaklaşık %5 uzatabilir; şarj edilebilir piller, türüne bağlı olarak şarjlarını çok daha uzun süre tutabilir. Maksimum voltajlarına ulaşmak için piller oda sıcaklığına getirilmelidir; bir alkalin pili 250 mA'da 0 °C'de boşaltmak, 20 °C'dekinin yalnızca yarısı kadar verimlidir. Duracell gibi alkalin pil üreticileri, pillerin soğutulmasını önermez.
Tehlikeler
Pil patlamasına genellikle birincil (şarj edilemeyen) bir pili yeniden şarj etmeye çalışmak veya bir kısa devre gibi yanlış kullanım veya arıza neden olur .
Bir pil aşırı hızda şarj edildiğinde, hidrojen ve oksijenden oluşan patlayıcı bir gaz karışımı , pilin içinden kaçabileceğinden daha hızlı üretilebilir (örn. yerleşik bir havalandırma yoluyla), bu da basıncın artmasına ve sonunda pilin patlamasına yol açar. pil kutusu. Aşırı durumlarda, pil kimyasalları kasadan şiddetli bir şekilde püskürebilir ve yaralanmaya neden olabilir. Sorunun bir uzman özeti, bu türün "lityum iyonlarını anot ve katot arasında taşımak için sıvı elektrolitler kullandığını. Bir pil hücresi çok hızlı şarj edilirse kısa devreye neden olarak patlamalara ve yangınlara neden olabilir" diyor. Bir kısa devre çok büyük akımlar ürettiğinde araba akülerinin patlaması muhtemeldir. Bu tür piller , aşırı şarj edildiklerinde ( elektrolit içindeki suyun elektrolizi nedeniyle) çok patlayıcı olan hidrojen üretirler . Normal kullanım sırasında, aşırı şarj miktarı genellikle çok küçüktür ve hızla dağılan az miktarda hidrojen üretir. Bununla birlikte, bir arabayı "takviye ile çalıştırırken", yüksek akım, örneğin bir aktarma kablosunun bağlantısını keserken, yakındaki bir kıvılcım tarafından patlayarak tutuşabilen büyük hacimlerde hidrojenin hızla salınmasına neden olabilir .
Aşırı şarj etme (pili elektrik kapasitesinin üzerinde şarj etmeye çalışmak), sızıntıya veya geri döndürülemez hasara ek olarak pilin patlamasına da yol açabilir. Ayrıca şarj cihazına veya aşırı şarj edilmiş pilin daha sonra kullanıldığı cihaza zarar verebilir.
Bir pilin yakılarak imha edilmesi, kapalı kasa içinde buhar biriktiği için patlamaya neden olabilir.
Birçok pil kimyasalı aşındırıcı, zehirli veya her ikisi birden. Kendiliğinden veya kaza sonucu sızıntı meydana gelirse, salınan kimyasallar tehlikeli olabilir. Örneğin, tek kullanımlık piller genellikle hem reaktan olarak hem de diğer reaktifleri tutmak için kap olarak bir çinko "kutu" kullanır. Bu tür bir pil aşırı boşalırsa, reaktifler kabın geri kalanını oluşturan karton ve plastikten dışarı çıkabilir. Aktif kimyasal sızıntı, pillerin çalıştırdığı ekipmana zarar verebilir veya devre dışı bırakabilir. Bu nedenle birçok elektronik cihaz üreticisi, uzun süre kullanılmayacak cihazların pillerinin çıkarılmasını önermektedir.
Birçok pil türü, elektrot veya elektrolit olarak kurşun, cıva ve kadmiyum gibi toksik maddeler kullanır. Her pil ömrünün sonuna geldiğinde çevreye zarar vermemek için imha edilmelidir. Piller elektronik atıkların (e-atık) bir türüdür. E-atık geri dönüşüm hizmetleri, daha sonra yeni piller için kullanılabilecek zehirli maddeleri geri kazanır. Amerika Birleşik Devletleri'nde her yıl satın alınan yaklaşık üç milyar pilin yaklaşık 179.000 tonu ülke genelinde çöplüklerde son buluyor.
Piller yutulduğunda zararlı veya ölümcül olabilir . Küçük düğme hücreler , özellikle küçük çocuklar tarafından yutulabilir. Sindirim sistemindeyken pilin elektrik boşalması doku hasarına yol açabilir; bu tür hasarlar bazen ciddi olabilir ve ölüme yol açabilir. Yutulan disk pilleri, mide-bağırsak sisteminde birikmedikçe genellikle sorunlara neden olmaz . Disk pillerinin takılacağı en yaygın yer yemek borusudur ve klinik sekellere neden olur . Yemek borusunu başarıyla geçen pillerin başka bir yere yerleşme olasılığı düşüktür. Bir disk pilinin yemek borusuna takılma olasılığı, hastanın yaşı ve pil boyutunun bir fonksiyonudur. Daha büyük çocuklar 21–23 mm'den küçük pillerle sorun yaşamazlar. Sıvılaşma nekrozu, pil tarafından üretilen akım tarafından (genellikle anotta) sodyum hidroksit üretildiğinden meydana gelebilir. Perforasyon, yuttuktan 6 saat sonra kadar hızlı bir şekilde meydana geldi.
Mevzuat ve yönetmelik
Elektrikli pillerle ilgili mevzuat, güvenli imha ve geri dönüşüm gibi konuları içerir.
Amerika Birleşik Devletleri'nde, 1996 tarihli Cıva İçeren ve Şarj Edilebilir Pil Yönetimi Yasası cıva içeren pillerin satışını yasakladı, yeniden şarj edilebilir piller için tek tip etiketleme gereklilikleri çıkardı ve şarj edilebilir pillerin kolayca çıkarılabilmesini şart koştu. California ve New York City, şarj edilebilir pillerin katı atık olarak imha edilmesini yasaklamaktadır. Şarj edilebilir pil endüstrisi, Amerika Birleşik Devletleri ve Kanada'da ülke çapında geri dönüşüm programları yürütür ve yerel perakendecilere teslim noktaları sunar.
Avrupa Birliği'nin Pil Yönergesi , pillerin daha fazla geri dönüştürülmesini zorunlu kılmanın ve iyileştirilmiş pil geri dönüşüm yöntemlerine ilişkin araştırmaları teşvik etmenin yanı sıra benzer gerekliliklere sahiptir. Bu direktif uyarınca, AB içinde satılacak tüm piller "toplama sembolü" (çarpı işaretli tekerlekli çöp kutusu) ile işaretlenmelidir. Bu, prizmatik pillerin yüzeyinin en az %3'ünü ve silindirik pillerin yüzeyinin en az %1,5'ini kaplamalıdır. Tüm ambalajlar aynı şekilde işaretlenmelidir.
Bildirilen kazalara ve arızalara, ara sıra tutuşma veya patlamaya yanıt olarak, lityum iyon pil kullanan cihazların geri çağrılması son yıllarda daha yaygın hale geldi.
Ayrıca bakınız
Referanslar
Kaynakça
- Dingrando, Laurel; et al. (2007). Kimya: Madde ve Değişim . New York: Glencoe/McGraw-Hill. ISBN 978-0-07-877237-5.Ch. 21 (s. 662–695) elektrokimya üzerinedir.
- Fink, Donald G. ; H. Wayne Beaty (1978). Elektrik Mühendisleri için Standart El Kitabı, Onbirinci Baskı . New York: McGraw-Hill. ISBN 978-0-07-020974-9.
- Şövalye, Randall D. (2004). Bilim Adamları ve Mühendisler İçin Fizik: Stratejik Bir Yaklaşım . San Francisco: Pearson Eğitimi. ISBN 978-0-8053-8960-9.Chs. 28–31 (s. 879–995) elektrik potansiyeli hakkında bilgi içerir.
- Linden, David; Thomas B.Reddy (2001). Piller El Kitabı . New York: McGraw-Hill. ISBN 978-0-07-135978-8.
- Saslow, Wayne M. (2002). Elektrik, Manyetizma ve Işık . Toronto: Thomson Learning. ISBN 978-0-12-619455-5.Chs. 8–9 (s. 336–418) piller hakkında daha fazla bilgi içerir.
Dış bağlantılar
-
 Wikimedia Commons'ta Elektrik pilleriyle ilgili medya
Wikimedia Commons'ta Elektrik pilleriyle ilgili medya - Piller ve Curlie
- Şarj edilemeyen piller
- HowStuffWorks: Piller nasıl çalışır?
- Diğer Pil Hücresi Türleri
- DoITPoMS Öğretme ve Öğrenme Paketi- "Piller"
- Fizik arXiv Blogu (17 Ağustos 2013). "Bütün Bir Pilin İlk Atom Seviyesi Simülasyonu | MIT Teknoloji İncelemesi" . Technologyreview.com . Erişim tarihi: 21 Ağustos 2013 .

















