Dendritik omurga - Dendritic spine
| dendritik omurga | |
|---|---|
 Bir striatal orta dikenli nöronun dikenli dendriti.
| |
 Yaygın dendritik diken türleri.
| |
| Detaylar | |
| tanımlayıcılar | |
| Latince | gemmula dendritik |
| ağ | D049229 |
| NS | H2.00.06.1.00036 |
|
Mikroanatominin anatomik terimleri | |
Bir dendritik omurga (ya da omurga ) bir nöronun küçük bir zar çıkıntıdır dendrit tipik olarak tek bir girdi alır akson de sinaps . Dendritik dikenler, sinaptik güç için bir depolama alanı görevi görür ve elektrik sinyallerinin nöronun hücre gövdesine iletilmesine yardımcı olur. Çoğu dikenin soğanlı bir başı (omurga başı) ve omurganın başını dendritin şaftına bağlayan ince bir boynu vardır. Tek bir nöronun dendritleri yüzlerce ila binlerce diken içerebilir. Bellek depolama ve sinaptik aktarım için anatomik bir alt tabaka sağlayan dikenlere ek olarak, nöronlar arasındaki olası temasların sayısını arttırmaya da hizmet edebilirler. Ayrıca nöronların aktivitelerindeki değişikliklerin omurga morfolojisi üzerinde olumlu bir etkisi olduğu öne sürülmüştür.
Yapı
Dendritik dikenler omurga kafa hacmi 0.01 uM arasında değişen küçük 3 bulundunuz 0.8 um 3 . Güçlü sinaptik temasları olan dikenler, tipik olarak, dendrite membranöz bir boyun yoluyla bağlanan büyük bir omurga kafasına sahiptir. Omurga şeklinin en dikkate değer sınıfları "ince", "küt", "mantar" ve "dallı"dır. Elektron mikroskobu çalışmaları, bu kategoriler arasında sürekli bir şekiller olduğunu göstermiştir. Değişken omurga şekli ve hacminin, her bir omurga sinapsının gücü ve olgunluğu ile ilişkili olduğu düşünülmektedir.
Dağıtım
Dendritik dikenler genellikle aksonlardan uyarıcı girdi alır, ancak bazen aynı omurga başı üzerinde hem engelleyici hem de uyarıcı bağlantılar yapılır . 2015 yılında Lichtman laboratuvarı tarafından gösterildiği gibi, dendritik dikenlere uyarıcı akson yakınlığı, bir sinapsın varlığını tahmin etmek için yeterli değildir .
Dikenler üzerinde bulunan dendritler en anapara nöronlar dahil olmak üzere beyinde, piramidal nöronlar arasında neokortekste , orta spinal nöronların ve striatum ve Purkinje hücreleri arasında beyincik . Dendritik dikenler, 5 diken/1 µm dendrit gerilmesine kadar bir yoğunlukta meydana gelir . Hipokampal ve kortikal piramidal nöronlar , diğer nöronlardan eşit sayıdaki dikenlerine on binlerce çoğunlukla uyarıcı girdi alabilirken , Purkinje nöron dendritlerindeki dikenlerin sayısı çok daha büyüktür.
Hücre iskeleti ve organeller
Dendritik dikenlerin hücre iskeleti, sinaptik plastisitelerinde özellikle önemlidir; dinamik bir hücre iskeleti olmadan, dikenler uyaranlara tepki olarak hacimlerini veya şekillerini hızla değiştiremezlerdi. Şekildeki bu değişiklikler, omurganın elektriksel özelliklerini etkileyebilir. Dendritik dikenlerin hücre iskeleti esas olarak filamentli aktin ( F-aktin )'den yapılmıştır. tubulin Monomerler ve mikrotübül ilişkili proteinler (MAP'ler) mevcuttur ve organize mikrotübüller mevcuttur. Omurgalar öncelikle aktin hücre iskeletine sahip olduklarından, bu onların şekil ve boyut olarak oldukça dinamik olmalarını sağlar. Aktin hücre iskeleti, omurganın morfolojisini doğrudan belirler ve aktin düzenleyiciler, Rac , RhoA ve CDC42 gibi küçük GTPazlar , bu hücre iskeletini hızla değiştirir. Aşırı aktif Rac1 , sürekli olarak daha küçük dendritik dikenlerle sonuçlanır.
Elektrofizyolojik aktivitelerine ve reseptör aracılı aktivitelerine ek olarak, dikenler veziküler olarak aktif görünmektedir ve hatta proteinleri çevirebilir . Dendritik dikenlerde düz endoplazmik retikulumun (SER'ler) yığılmış diskleri tanımlanmıştır. Bu " omurga aparatının " oluşumu , protein sinaptopodine bağlıdır ve kalsiyumun işlenmesinde önemli bir rol oynadığına inanılmaktadır. Dendritik dikenlerde veziküler aktiviteyi destekleyen "pürüzsüz" veziküller de dikenlerde tanımlanmıştır. Dikenlerde poliribozomların mevcudiyeti, sadece dendritte değil, omurganın kendisinde de protein translasyon aktivitesini düşündürür.
morfogenez
Dendritik dikenlerin morfogenezi, uzun süreli güçlenmenin (LTP) uyarılması için kritik öneme sahiptir . Omurga morfolojisi durumları bağlıdır aktin globular (G-aktin) ve ipliksi (F-aktin) formlarda, ya. Rho GTPaz ailesinin rolü ve aktin stabilitesi ve omurga hareketliliği üzerindeki etkileri, bellek için önemli etkilere sahiptir. Dendritik omurga bilgi depolamanın temel birimiyse, omurganın kendiliğinden uzama ve geri çekilme yeteneği kısıtlanmalıdır. Aksi takdirde, bilgiler kaybolabilir. Rho GTPaz ailesi, omurganın boyutunu ve şeklini artıran aktin polimerizasyonunu uyaran sürece önemli katkılarda bulunur. Büyük dikenler, küçük olanlardan daha kararlıdır ve ilave sinaptik aktivite ile modifikasyona dirençli olabilir. Dendritik dikenlerin şeklindeki ve boyutundaki değişiklikler, uyarıcı sinaptik bağlantıların gücü ile ilişkili olduğundan ve büyük ölçüde altta yatan aktin hücre iskeletinin yeniden şekillenmesine bağlı olduğundan, aktin düzenlemesinin spesifik mekanizmaları ve dolayısıyla Rho GTPaz ailesi, oluşumun ayrılmaz bir parçasıdır. , dendritik dikenlerin olgunlaşması ve plastisitesi ve öğrenme ve hafıza.
RhoA yolu
Omurga morfogenezinde rol oynayan başlıca Rho GTPazlardan biri, hücre bölünmesinin düzenlenmesini ve zamanlamasını da modüle eden bir protein olan RhoA'dır . Nöronlardaki aktivite bağlamında, RhoA şu şekilde aktive edilir: kalsiyum bir hücreye NMDA reseptörleri yoluyla girdiğinde , kalmodulin'e bağlanır ve RhoA'nın aktivasyonuna yol açan CaMKII'yi aktive eder. RhoA proteininin aktivasyonu, bir RhoA kinazı olan ROCK'u aktive edecek ve bu da LIM kinazın uyarılmasına yol açacak ve bu da protein kofilini inhibe edecektir . Cofilin'in işlevi, bir hücrenin aktin hücre iskeletini yeniden düzenlemektir; yani, aktin segmentlerini depolimerize eder ve böylece büyüme konilerinin büyümesini ve aksonların onarımını engeller.
Murakoshi ve ark. 2011 yılında, dendritik omurga morfogenezinde Rho GTPaz RhoA ve Cdc42'yi dahil etti. Her iki GTPaz da , uzun süreli güçlenme uyaranlarının neden olduğu yapısal plastisite sırasında sıçan hipokampusunun CA1 bölgesindeki piramidal nöronların tek dendritik dikenlerinde hızla aktive edildi . Eşzamanlı RhoA ve Cdc42 aktivasyonu, omurga büyümesinde beş dakika boyunca %300'e kadar geçici bir artışa yol açtı, bu da otuz dakika boyunca daha küçük ama sürekli bir büyümeye dönüştü. RhoA'nın aktivasyonu, uyarıya maruz kalan omurganın çevresine yayıldı ve RhoA'nın geçici faz ve büyük olasılıkla omurga büyümesinin yanı sıra sürekli fazı için gerekli olduğu belirlendi.
Cdc42 yolu
Cdc42, dendritik büyüme, dallanma ve dal stabilitesi dahil olmak üzere birçok farklı işlevde yer almıştır. NMDA reseptörleri yoluyla hücreye kalsiyum girişi, kalmodulin'e bağlanır ve Ca2+/kalmodulin bağımlı protein kinaz II'yi (CaMKII) aktive eder. Sırayla, CaMKII etkinleştirilir ve bu, Cdc42'yi etkinleştirir, bundan sonra kalsiyum ve CaMKII'nin yukarısında hiçbir geri besleme sinyali oluşmaz. Monomerik ile güçlendirilmiş yeşil floresan protein ile etiketlenirse, Cdc42'nin aktivasyonunun sadece bir dendritin uyarılmış omurgası ile sınırlı olduğu görülebilir. Bunun nedeni, molekülün plastisite sırasında sürekli olarak aktif hale gelmesi ve omurga dışına yayıldıktan sonra hemen inaktive olmasıdır. Bölümlere ayrılmış aktivitesine rağmen, Cdc42, tıpkı RhoA gibi, uyarılmış omurganın dışında hala hareketlidir. Cdc42, spesifik olarak fosforile eden ve dolayısıyla ADF/kofilini inaktive eden bir protein kinaz olan PAK'ı aktive eder. Kofilinin inaktivasyonu, aktin polimerizasyonunun artmasına ve omurganın hacminin genişlemesine yol açar. Spinal hacimdeki bu artışın sürdürülebilmesi için Cdc42'nin aktivasyonu gereklidir.
Yapısal plastisitede gözlenen değişiklikler

Murakoshi, Wang ve Yasuda (2011), Rho GTPaz aktivasyonunun tek dendritik dikenlerin yapısal plastisitesi üzerindeki etkilerini incelemiş ve geçici ve sürekli fazlar arasındaki farkları aydınlatmıştır.
Yapısal plastisitede geçici değişiklikler
Tek bir dendritik omurgada düşük frekanslı iki fotonlu glutamat kafes açma treninin uygulanması, hem RhoA hem de Cdc42'nin hızlı aktivasyonunu sağlayabilir. Sonraki iki dakika boyunca, uyarılmış omurganın hacmi orijinal boyutunun yüzde 300'üne kadar genişleyebilir. Ancak omurga morfolojisindeki bu değişiklik geçicidir; omurganın hacmi beş dakika sonra azalır. Bir Rho inhibitörü olan C3 transferazın veya bir Rock inhibitörü olan glisil-H1152'nin uygulanması, omurganın geçici genişlemesini engeller ve bu işlem için bir şekilde Rho-Rock yolunun aktivasyonunun gerekli olduğunu gösterir.
Yapısal plastisitede sürekli değişiklikler
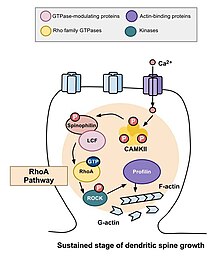
Yukarıda açıklanan geçici değişiklikler gerçekleştikten sonra, omurganın hacmi, orijinal hacminin yüzde 70 ila 80'i kadar yükselene kadar azalır. Yapısal plastisitedeki bu sürekli değişiklik yaklaşık otuz dakika sürecektir. Bir kez daha, C3 transferaz ve Glycyl-H1152 uygulaması bu büyümeyi baskıladı, bu da spinal hacimde daha kalıcı artışlar için Rho-Rock yolunun gerekli olduğunu düşündürdü. Ek olarak, Wasp'in Cdc42 bağlama alanının veya Pak1 aktivasyon-3'ü (IPA3) hedefleyen inhibitörün uygulanması, hacimdeki bu sürekli büyümeyi azaltır, bu da spinal hacimdeki bu büyüme için Cdc42-Pak yolunun gerekli olduğunu gösterir. Bu önemlidir, çünkü yapısal plastisitedeki sürekli değişiklikler, anıların kodlanması, sürdürülmesi ve geri alınması için bir mekanizma sağlayabilir. Yapılan gözlemler, bu işlemler için Rho GTPaz'ların gerekli olduğunu düşündürebilir.
fizyoloji
alıcı aktivite
Dendritik dikenler , yüzeylerinde glutamat reseptörlerini (örneğin AMPA reseptörü ve NMDA reseptörü ) eksprese eder . TrkB reseptörü BDNF da omurga yüzeyinde ifade edilir ve omurga hayatta kalmasında rol oynadığına inanılmaktadır. Omurganın ucu, " postsinaptik yoğunluk " (PSD) olarak adlandırılan elektron yoğun bir bölge içerir . PSD , sinaps yapan aksonunun aktif bölgesini doğrudan belirler ve omurganın zar yüzey alanının ~%10'unu oluşturur; aktif bölgeden salınan nörotransmiterler, omurganın postsinaptik yoğunluğundaki reseptörleri bağlar. Sinaps yapan aksonların ve dendritik dikenlerin yarısı, iki nöron arasında hücreden hücreye yapışık bağlantılar oluşturan kalsiyuma bağımlı kaderin tarafından fiziksel olarak bağlanır .
Glutamat reseptörleri (GluR'ler) postsinaptik yoğunluğa lokalizedir ve hücre iskeleti elemanları tarafından zara sabitlenir. Bunlar içine GluRs tarafından iletilen sinyaller sağlayarak, tipik haliyle, plazma membranının alt gergin onların sinyal makine, üzerinde konumlanmıştır sitoplazmada daha fazla aktive etme yakın sinyal elemanları tarafından yayılan için sinyal iletim olay zincirleri . GluR'ler, yakındaki sinyalciler olmadan belirli aşağı akış etkilerini etkileyemeyeceğinden, sinyalleme elemanlarının kendi GluR'lerine lokalizasyonu, sinyal kademeli aktivasyonunun sağlanmasında özellikle önemlidir.
GluR'lerden gelen sinyallere, postsinaptik yoğunluğa lokalize olan, özellikle kinazlar olmak üzere, bol miktarda proteinin mevcudiyeti aracılık eder. Bunlara kalsiyum bağımlı kalmodulin , CaMKII (kalmodulin bağımlı protein kinaz II), PKC (Protein Kinaz C), PKA (Protein Kinaz A), Protein Fosfataz-1 (PP-1) ve Fyn tirozin kinaz dahildir . CaMKII gibi belirli sinyaller, aktiviteye yanıt olarak yukarı doğru düzenlenir.
Omurgalar, biyokimyasal sinyalleri bölümlere ayırarak nöronlar için özellikle avantajlıdır. Bu, aynı nöronun diğer sinapslarının durumunu etkilemeden bireysel bir sinapsın durumundaki değişiklikleri kodlamaya yardımcı olabilir. Omurga boynunun uzunluğu ve genişliği, ince dikenler en biyokimyasal olarak izole edilmiş dikenler olmak üzere, bölümlendirme derecesi üzerinde büyük bir etkiye sahiptir.
plastisite
Dendritik dikenler çok "plastiktir", yani dikenler küçük zaman dilimlerinde şekil, hacim ve sayı olarak önemli ölçüde değişir. Omurgalar öncelikle bir aktin hücre iskeletine sahip oldukları için dinamiktirler ve aktin yeniden şekillenmesinin dinamikliği nedeniyle dikenlerin çoğu saniyeler ila dakikalar içinde şekil değiştirir . Ayrıca, omurga sayısı çok değişkendir ve dikenler gelir ve gider; Birkaç saat içinde, daha büyük "mantar" şeklindeki dikenler en kararlı olmasına rağmen, dikenlerin %10-20'si serebral korteksin piramidal hücrelerinde kendiliğinden ortaya çıkabilir veya kaybolabilir.
Omurga bakımı ve plastisite, aktiviteye bağımlı ve aktiviteden bağımsızdır. BDNF , omurga seviyelerini kısmen belirler ve omurganın hayatta kalmasını sağlamak için düşük seviyelerde AMPA reseptör aktivitesi gereklidir ve NMDA reseptörlerini içeren sinaptik aktivite, omurga büyümesini teşvik eder. Ayrıca, iki foton lazer tarama mikroskopisi ve konfokal mikroskopi, omurga hacminin bir sinapsa sunulan uyaran türlerine bağlı olarak değiştiğini göstermiştir.
Öğrenme ve hafızanın önemi
Önem kanıtı
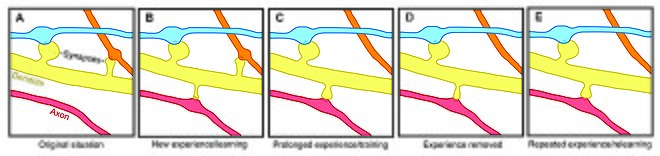
Omurga plastisitesi motivasyon , öğrenme ve hafıza ile ilişkilidir . Özellikle, uzun süreli belleğe , belirli bir sinir yolunu güçlendirmek için kısmen yeni dendritik dikenlerin büyümesi (veya önceden var olan dikenlerin genişlemesi) aracılık eder. Dendritik dikenler, ömrü girdi aktivitesinden etkilenen plastik yapılar olduğundan, omurga dinamikleri, bir ömür boyu hafızanın korunmasında önemli bir rol oynayabilir.
Omurga devir hızındaki yaşa bağlı değişiklikler, omurga stabilitesinin gelişimsel öğrenmeyi etkilediğini göstermektedir. Gençlerde, dendritik omurga döngüsü nispeten yüksektir ve net bir omurga kaybı oluşturur. Bu yüksek omurga devir hızı, gelişimin kritik dönemlerini karakterize edebilir ve ergenlikteki öğrenme kapasitesini yansıtabilir - farklı kortikal alanlar, gelişim sırasında muhtemelen belirli beyin bölgeleri için değişen kritik dönemleri yansıtan farklı sinaptik devir seviyeleri sergiler . Ancak yetişkinlikte, çoğu diken kalıcı kalır ve dikenlerin yarı ömrü artar. Bu stabilizasyon, olgunlukta anıların stabilizasyonunun altında yatan bir süreç olan, omurga eliminasyonunun gelişimsel olarak düzenlenmiş bir yavaşlaması nedeniyle oluşur.
Dendritik omurga stabilitesindeki deneyime bağlı değişiklikler, uzun süreli hafızanın korunmasında yer alan bir mekanizma olarak omurga döngüsüne de işaret eder, ancak duyusal deneyimin nöral devreleri nasıl etkilediği belirsizdir. İki genel model, deneyimin yapısal plastisite üzerindeki etkisini tanımlayabilir. Bir yandan, deneyim ve aktivite, öğrenmeye izin vermek için anlamlı bilgileri depolayan ilgili sinaptik bağlantıların ayrık oluşumunu yönlendirebilir. Öte yandan, aşırı sinaptik bağlantılar kurulabilir ve deneyim ve aktivite, yabancı sinaptik bağlantıların budanmasına yol açabilir.
Her yaştan laboratuar hayvanlarında, çevresel zenginleşme dendritik dallanma, omurga yoğunluğu ve toplam sinaps sayısı ile ilişkilendirilmiştir. Ek olarak, beceri eğitiminin, eski omurgaları istikrarsızlaştırırken yeni omurgaların oluşumuna ve dengelenmesine yol açtığı gösterilmiştir, bu da yeni bir becerinin öğrenilmesinin sinir devrelerinin yeniden kablolanma sürecini içerdiğini düşündürmektedir. Omurganın yeniden şekillenmesinin kapsamı, öğrenmenin başarısı ile ilişkili olduğundan, bu, hafıza oluşumunda sinaptik yapısal plastisitenin çok önemli bir rolü olduğunu düşündürür. Ayrıca, omurga stabilitesi ve güçlenmesindeki değişiklikler hızla meydana gelir ve antrenmandan sonraki saatler içinde gözlemlenir.
Tersine, zenginleştirme ve eğitim, omurga oluşumu ve stabilitesindeki artışlarla ilgiliyken, uzun vadeli duyusal yoksunluk , omurga eliminasyon oranında bir artışa yol açar ve bu nedenle uzun vadeli nöral devreleri etkiler. Ergenlikte yoksunluktan sonra duyusal deneyimin geri kazanılmasıyla, omurga eliminasyonu hızlanır, bu da deneyimin gelişim sırasında net omurga kaybında önemli bir rol oynadığını gösterir. Ek olarak, bıyık kırpma gibi diğer duyusal yoksunluk paradigmalarının yeni dikenlerin stabilitesini arttırdığı gösterilmiştir.
Nörolojik hastalıklar ve yaralanmalarla ilgili araştırmalar, omurga döngüsünün doğası ve önemine daha fazla ışık tuttu. İnmeden sonra , travma bölgesinin yakınında yapısal plastisitede belirgin bir artış meydana gelir ve omurga döngüsünde kontrol oranlarından beş ila sekiz kat artış gözlemlenmiştir. Dendritler iskemi sırasında hızla parçalanır ve yeniden birleşir - felçte olduğu gibi, hayatta kalanlar dendritik omurga döngüsünde bir artış gösterdi. Alzheimer hastalığında ve zihinsel engelli vakalarında net bir omurga kaybı gözlenirken , kokain ve amfetamin kullanımı, prefrontal korteks ve nükleus akumbensinde dendritik dallanma ve omurga yoğunluğundaki artışlarla ilişkilendirilmiştir . Çeşitli beyin hastalıklarında omurga yoğunluğunda önemli değişiklikler meydana geldiğinden, bu, normal koşullarda, değişen patolojik koşullar altında dengesizliğe duyarlı olabilen dengeli bir omurga dinamiği durumunu gösterir.
Yaşlanmanın bir sonucu olarak dendritik dikenlerin kaybına dair bazı kanıtlar da vardır. Fareleri kullanan bir çalışma, hipokampustaki omurga yoğunluklarında yaşa bağlı azalmalar ile hipokampal öğrenme ve hafızada yaşa bağlı düşüşler arasında bir ilişki olduğunu kaydetti.
Önemi tartışmalı
Dendritik omurga dinamiklerinin öğrenme ve hafızaya aracılık etmede bir rolü olduğunu öne süren deneysel bulgulara rağmen, yapısal plastisitenin önemi tartışmalıdır. Örneğin, araştırmalar, eğitim sırasında oluşan omurgaların yalnızca küçük bir bölümünün yaşam boyu öğrenmeye gerçekten katkıda bulunduğunu tahmin ediyor. Ek olarak, yeni dikenlerin oluşumu beynin bağlanabilirliğine önemli ölçüde katkıda bulunmayabilir ve omurga oluşumu, omurga başlarının büyüklüğündeki artış gibi yapısal plastisitenin diğer özellikleri kadar hafızanın tutulması üzerinde çok fazla bir etkiye sahip olmayabilir.
modelleme
Teorisyenler, onlarca yıldır dikenlerin potansiyel elektriksel işlevi hakkında varsayımlarda bulundular, ancak elektriksel özelliklerini inceleyemememiz, yakın zamana kadar teorik çalışmanın çok fazla ilerlemesini engelledi. İki fotonlu glutamat kafesten çıkarmanın artan kullanımıyla birlikte görüntüleme tekniklerindeki son gelişmeler, çok sayıda yeni keşfe yol açmıştır; Artık omurga başlarında voltaja bağlı sodyum, potasyum ve kalsiyum kanalları olduğundan şüpheleniyoruz.
Kablo teorisi , pasif sinir lifleri boyunca elektrik akımlarının akışını modellemek için en "basit" yöntemin arkasındaki teorik çerçeveyi sağlar. Her bir omurga, biri boynu, diğeri omurga başını temsil eden iki bölme olarak ele alınabilir. Tek başına omurga başını temsil eden bölme aktif özellikleri taşımalıdır.
Baer ve Rinzel'in süreklilik modeli
Birçok diken arasındaki etkileşimlerin analizini kolaylaştırmak için Baer & Rinzel, dikenlerin dağılımının bir süreklilik olarak ele alındığı yeni bir kablo teorisi formüle etti. Bu gösterimde, omurga başı voltajı, bitişik dikenlerdeki zar potansiyelinin yerel uzaysal ortalamasıdır. Formülasyon, komşu dikenler arasında doğrudan elektriksel bağlantı olmaması özelliğini korur; dendritler boyunca yayılan voltaj, dikenlerin etkileşime girmesinin tek yoludur.
Spike-diffuse-spike modeli
SDS modeli, tam Baer ve Rinzel modelinin hesaplama açısından basit bir versiyonu olarak tasarlandı. Analitik olarak izlenebilir olacak ve omurga boyun direnci gibi en büyük öneme sahip olanları korurken mümkün olduğunca az serbest parametreye sahip olacak şekilde tasarlanmıştır. Model, süreklilik yaklaşımını bırakır ve bunun yerine ayrı noktalarda uyarılabilir dikenlere bağlı pasif bir dendrit kullanır. Omurgalardaki membran dinamikleri, entegre ve ateş süreçleri kullanılarak modellenmiştir. Ani olaylar, geleneksel olarak dikdörtgen bir fonksiyon olarak temsil edilen dalga formuyla ayrık bir tarzda modellenir.
Omurga kalsiyum geçişlerinin modellenmesi
Dikenlerdeki geçici kalsiyum olayları, sinaptik plastisite için önemli bir tetikleyicidir. Kalsiyum için yüksek geçirgenliğe sahip olan NMDA reseptörleri , yalnızca membran potansiyeli yeterince depolarize olduğunda iyonları iletir. Sinaptik aktivite sırasında bir omurgaya giren kalsiyum miktarı, bu nedenle, omurga başının depolarizasyonuna bağlıdır. Kalsiyum görüntüleme deneylerinden ( iki foton mikroskopisi ) ve kompartman modellemesinden elde edilen kanıtlar, yüksek dirençli boyunlara sahip dikenlerin sinaptik aktivite sırasında daha büyük kalsiyum geçişleri yaşadığını gösterir.
Gelişim
Dendritik dikenler, doğrudan dendritik şaftlardan veya dendritik filopodiadan gelişebilir . Sırasında sinaptogenez hızla Filiz ve geri çekme filopodia, küçük zar organel eksik membranöz çıkıntıları dendritlerindeki. Son zamanlarda, I-BAR proteini MIM'in başlatma sürecine katkıda bulunduğu bulundu. Doğumun ilk haftasında, beyin, sonunda sinaps geliştiren filopodia tarafından baskındır. Bununla birlikte, bu ilk haftadan sonra, filopodia'nın yerini dikenli dendritlerin yanı sıra, dikenli dendritlerden çıkıntı yapan küçük, küt dikenler de alır. Bazı filopodiaların dikenlere dönüşmesinde filopodia, dendrite presinaptik teması sağlar, bu da presinaptik çıkıntılarla özel postsinaptik teması işlemek için dikenlerin üretimini teşvik eder.
Bununla birlikte, dikenler, oluşumdan sonra olgunlaşma gerektirir. Olgunlaşmamış dikenler bozulmuş sinyal yeteneklerine sahiptir ve tipik olarak "başları" yoktur (veya çok küçük kafaları vardır), yalnızca boyunları vardır, olgunlaşmış dikenler ise hem başları hem de boyunları korur.
Klinik önemi
DEHB , Alzheimer hastalığı , otizm , zihinsel engellilik ve kırılgan X sendromu gibi bilişsel bozukluklar dendritik dikenlerdeki anormalliklerden, özellikle de diken sayısı ve olgunluğundan kaynaklanabilir. Olgunlaşmamış dikenler bozulmuş sinaptik sinyale sahip olduğundan, olgunlaşmış dikenlerin olgunlaşmamış dikenlere oranı, sinyallerinde önemlidir. Frajil X sendromu, kortikal dendritlerde çoklu filopodiaya sahip olgunlaşmamış dikenlerin fazlalığı ile karakterize edilir.
Tarih
Dendritik dikenler ilk olarak 19. yüzyılın sonunda Santiago Ramón y Cajal tarafından serebellar nöronlar üzerinde tanımlanmıştır. Ramón y Cajal daha sonra dendritik dikenlerin nöronlar arasında temas bölgeleri olarak hizmet edebileceğini öne sürdü. Bu, elektron mikroskobunun ortaya çıkması sayesinde 50 yıldan fazla bir süre sonra gösterildi. Canlı dokular üzerinde konfokal mikroskopi geliştirilinceye kadar, omurgaların embriyonik gelişim sırasında oluştuğu ve doğumdan sonra sabit kalacağı yaygın olarak kabul edildi. Bu paradigmada, sinaptik ağırlık varyasyonlarının hücresel düzeyde bellek süreçlerini açıklamak için yeterli olduğu düşünülmüştür. Ancak yaklaşık on yıl öncesinden beri, yeni konfokal mikroskopi teknikleri, dendritik dikenlerin, doğumdan sonra bile sürekli bir dönüşüme uğrayan gerçekten hareketli ve dinamik yapılar olduğunu gösterdi.
Referanslar
daha fazla okuma
- Sudhof, TC; Stevens, CF; Cowan, WM (2001). Sinapslar . Baltimore: Johns Hopkins University Press. ISBN'si 978-0-8018-6498-8.
- Levitan, IB; Kaczmarek, LK (2002). Nöron: Hücre ve Moleküler Biyoloji (Üçüncü baskı). New York: Oxford University Press. ISBN'si 978-0-19-514522-9.
- Nimchinsky E, Sabatini B, Svoboda K (2002). "Dendritik dikenlerin yapısı ve işlevi". Annu Rev Physiol . 64 : 313-53. doi : 10.1146/annurev.physicol.64.081501.160008 . PMID 11826272 .
- Matsuzaki M, Honkura N, Ellis-Davies G, Kasai H (2004). "Tek dendritik dikenlerde uzun vadeli güçlendirmenin yapısal temeli" . Doğa . 429 (6993): 761–6. Bibcode : 2004Natur.429..761M . doi : 10.1038/nature02617 . PMC 4158816 . PMID 15190253 .
- Yuste R, Majewska A, Holthoff K (2000). "Biçimden işleve: dendritik dikenlerde kalsiyum bölümlendirme". Nat Neurosci . 3 (7): 653–9. doi : 10.1038/76609 . PMID 10862697 . S2CID 33466678 .
- Lieshoff C, Bischof H (2003). "Omurga yoğunluğunun dinamikleri değişir". Davranış Beyin Arş . 140 (1–2): 87–95. doi : 10.1016/S0166-4328(02)00271-1 . PMID 12644282 . S2CID 2275781 .
- Kasai H, Matsuzaki M, Noguchi J, Yasumatsu N (2002). "Dendritik omurga yapıları ve işlevleri". Nihon Shinkei Seishin Yakurigaku Zasshi . 22 (5): 159-64. PMID 12451686 .
- Lynch G, Rex CS, Gall CM (2007). "LTP konsolidasyonu: substratlar, açıklayıcı güç ve işlevsel önemi". Nörofarmakoloji . 52 (1): 12–23. doi : 10.1016/j.neuropharm.2006.07.027 . PMID 16949110 . S2CID 22652804 .