kalorimetri - Calorimetry
Kalorimetri , örneğin kimyasal reaksiyonlara , fiziksel değişikliklere veya belirli kısıtlamalar altında faz geçişlerine bağlı olarak durumundaki değişikliklerle ilişkili ısı transferini türetmek amacıyla bir cismin durum değişkenlerindeki değişiklikleri ölçme bilimi veya eylemidir . Kalorimetre, bir ile gerçekleştirilir kalorimetre . Kelimesinin kalorimetrisi Latince kelime türetilmiştir CALOR ısı ve Yunanca kelime, yani μέτρον ölçü anlamına (metron). Isı ve sıcaklık arasındaki farkı ilk fark eden İskoç doktor ve bilim adamı Joseph Black'in kalorimetri biliminin kurucusu olduğu söylenir.
Dolaylı kalorimetri , canlı organizmaların ya karbondioksit ve nitrojen atığı ( suda yaşayan organizmalarda genellikle amonyak veya karada yaşayanlarda üre ) üretimlerini ya da oksijen tüketimlerini ölçerek ürettikleri ısıyı hesaplar . Lavoisier 1780'de oksijen tüketiminden ısı üretiminin çoklu regresyon kullanılarak bu şekilde tahmin edilebileceğini belirtti . Dinamik enerji bütçesi bu prosedür doğru neden teori açıklıyor. Canlı organizmalar tarafından üretilen ısı aynı zamanda ölçülebilir doğrudan kalorimetre tüm organizma ölçümü için kalorimetre içine yerleştirildiği,.
Yaygın olarak kullanılan modern bir araç, küçük miktarlarda malzeme üzerinde termal verilerin elde edilmesini sağlayan bir cihaz olan diferansiyel tarama kalorimetresidir . Numuneyi kontrollü bir hızda ısıtmayı ve numunenin içine veya numuneden gelen ısı akışını kaydetmeyi içerir.
Klasik kalorimetrik ısı hesaplaması
Tek bileşenli bir gövde için türevlenebilir durum denklemi olan durumlar
Hacme göre temel klasik hesaplama
Kalorimetri, sıcaklığı değiştiren bir referans malzemenin bilinen kesin termal yapısal özelliklere sahip olmasını gerektirir. Clausius ve Kelvin tarafından tanınan klasik kural, kalorimetrik malzeme tarafından uygulanan basıncın tamamen ve hızlı bir şekilde yalnızca sıcaklığı ve hacmi tarafından belirlendiğidir; bu kural, buzun erimesi gibi faz değişikliği içermeyen değişiklikler içindir. Bu kurala uymayan birçok malzeme vardır ve onlar için klasik kalorimetrinin mevcut formülü yeterli bir açıklama sağlamamaktadır. Burada kullanılan kalorimetrik malzeme için klasik kuralın geçerli olduğu varsayılır ve önermeler matematiksel olarak yazılır:
Kalorimetrik malzemenin termal tepkisi, sadece hacim ve sıcaklığın yapısal fonksiyonunun değeri olarak basıncı ile tam olarak tanımlanır . Buradaki tüm artışların çok küçük olması gerekir. Bu hesaplama, faz değişiminin olmadığı ve sadece bir fazın mevcut olduğu vücudun hacim ve sıcaklık alanını ifade eder. Burada önemli bir varsayım, mülkiyet ilişkilerinin sürekliliğidir. Faz değişimi için farklı bir analiz gerekiyor
Kalorimetrik bir gövde tarafından , hacminde ve sıcaklığında küçük artışlarla küçük bir ısı artışı elde edildiğinde, kalorimetrik malzemenin gövdesi tarafından kazanılan ısı artışı , ile verilir.
nerede
- sabit kontrollü sıcaklıkta kalorimetrik malzemenin hacmine göre gizli ısısını belirtir . Çevrenin malzeme üzerindeki basıncı, başlangıç hacmi ile birlikte seçilen bir hacim değişikliğini empoze etmek için araçsal olarak ayarlanır . Bu gizli ısıyı belirlemek için, hacim değişimi etkin bir şekilde bağımsız olarak araçsal olarak değişen miktardır. Bu gizli ısı, yaygın olarak kullanılanlardan biri değildir, ancak teorik veya kavramsal olarak ilgi çekicidir.
- Kalorimetrik malzemenin sabit sabit hacimdeki ısı kapasitesini belirtirken, malzemenin basıncının başlangıç sıcaklığı ile serbestçe değişmesine izin verilir . Sıcaklık, uygun bir ısı banyosuna maruz bırakılarak değişmeye zorlanır. Basitçe veya daha kısaca olarak yazmak gelenekseldir . Bu gizli ısı, yaygın olarak kullanılan iki ısıdan biridir.
Hacme göre gizli ısı, sabit sıcaklıkta hacimdeki birim artış için gerekli olan ısıdır. 'Bir izoterm boyunca ölçüldüğü' söylenebilir ve malzemenin uyguladığı basıncın, kurucu yasasına göre serbestçe değişmesine izin verilir . Belirli bir malzeme için, pozitif veya negatif bir işarete sahip olabilir veya istisnai olarak sıfır olabilir ve bu, yaklaşık 4 C su için olduğu gibi sıcaklığa bağlı olabilir. Hacme göre gizli ısı kavramı belki de ilk kez fark edildi. tarafından Joseph Siyah 1762 vadeli 'genişleme gizli ısı' de kullanılmaktadır. Hacme göre gizli ısı, 'hacime göre gizli enerji' olarak da adlandırılabilir. 'Gizli ısı'nın tüm bu kullanımları için, daha sistematik bir terminoloji 'gizli ısı kapasitesini' kullanır.
Sabit hacimde ısı kapasitesi, sabit hacimde sıcaklıktaki birim artış için gerekli olan ısıdır. 'Bir izokor boyunca ölçüldüğü' söylenebilir ve yine malzemenin uyguladığı basıncın serbestçe değişmesine izin verilir. Her zaman olumlu bir işareti vardır. Bu, bir cismin hacmini değiştirmeden sıcaklığındaki bir artış için, ona ısı verilmesi gerektiği anlamına gelir. Bu, ortak deneyimle tutarlıdır.
Gibi nicelikler bazen 'eğri diferansiyelleri' olarak adlandırılır, çünkü bunlar yüzeydeki eğriler boyunca ölçülür .
Sabit hacimli (izokorik) kalorimetri için klasik teori
Sabit hacimli kalorimetri, sabit bir hacimde gerçekleştirilen kalorimetridir . Bu, sabit hacimli bir kalorimetrenin kullanımını içerir . Isı hala yukarıda belirtilen kalorimetri prensibi ile ölçülür.
Bu, bomba kalorimetresi olarak adlandırılan, uygun şekilde yapılmış bir kalorimetrede, hacim artışının kaybolması için yapılabileceği anlamına gelir . Sabit hacimli kalorimetri için:
nerede
- sıcaklıktaki artışı ifade eder ve
- sabit hacimdeki ısı kapasitesini gösterir .
Basınca göre klasik ısı hesabı
Hacme göre ısı hesaplamasının yukarıdaki kuralından, basınca göre bir tane gelir.
Küçük artışlarla, basıncında ve sıcaklığındaki bir süreçte, kalorimetrik malzemenin gövdesi tarafından kazanılan ısı artışı , şu şekilde verilir:
nerede
- vücut hacmi ve basıncının basınç ve sıcaklıkta serbestçe değişmesine izin verilirken, kalorimetrik malzemenin sabit sıcaklıkta basınca göre gizli ısısını belirtir ;
- Kalorimetrik malzemenin sabit basınçtaki ısı kapasitesini gösterirken, vücut sıcaklığı ve hacminin basınç ve sıcaklıkta serbestçe değişmesine izin verilir . Basitçe veya daha kısaca olarak yazmak gelenekseldir .
Buradaki yeni miktarlar öncekilerle ilgilidir:
nerede
- temsil eder kısmi türev arasında göre değerlendirildi
ve
- için değerlendirilen ile ilgili kısmi türevi belirtir .
Gizli ısıtır ve her zaman zıt işaretlidir.
Özgül ısıların oranına şu şekilde atıfta bulunmak yaygındır:
- genellikle sadece olarak yazılır .
Faz değişimi yoluyla kalorimetri, durum denklemi bir sıçrama süreksizliği gösterir
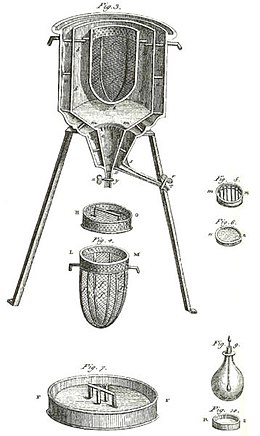
Yukarıdaki şekilde gösterildiği gibi, Laplace ve Lavoisier tarafından kullanılan erken bir kalorimetreydi . Sabit sıcaklıkta ve atmosfer basıncında çalıştı. İlgili gizli ısı, faz değişimi olmadan kalorimetri için yukarıdaki hesapta olduğu gibi, hacim veya basınç bakımından gizli bir ısı değildi. Bu kalorimetrede yer alan gizli ısı, sabit sıcaklıkta doğal olarak meydana gelen faz değişimi ile ilgiliydi. Bu tür kalorimetre, bir faz değişimi olan buzun erimesiyle üretilen su kütlesinin ölçülmesiyle çalışır .
Isıtma Kümülasyonu
Sürekli bir ortak ilerlemesi ile tanımlanan kalorimetrik malzemeden ısıtılması zamana bağlı bir işlem için bir ve zaman başlayan ve zaman sona eren , teslim bir ısı birikmiş miktarı orada hesaplanabilir . Bu hesaplama, zamana göre ilerleme boyunca matematiksel entegrasyon ile yapılır . Bunun nedeni, ısı artışlarının 'katkı' olmasıdır; ancak bu, ısının muhafazakar bir miktar olduğu anlamına gelmez. Isının muhafazakar bir miktar olduğu fikri Lavoisier tarafından icat edildi ve ' kalori teorisi ' olarak adlandırılıyor ; on dokuzuncu yüzyılın ortalarında yanlış olarak kabul edildi. sembolü ile yazılan miktar , hiç de çok küçük değerlerle bir artışla sınırlı değildir; bu karşıtlıktır .
Biri yazabilir
- .
Bu ifade, aşağıdaki 'Yukarıdaki kuralların matematiksel yönleri' başlıklı bölümde tanımlanan miktarları kullanır .
Yukarıdaki kuralların matematiksel yönleri
Miktarın 'hızlı bir şekilde belirlenmesi' için fiziksel gereklilikle ilgili olan 'çok küçük' miktarların kullanımı ve ; bu tür 'hızlı belirleme' fiziksel bir süreci ifade eder. Bu 'çok küçük' miktarlar, Leibniz'in sonsuz küçükler hesabına yaklaşımında kullanılır . Newton yaklaşımı yerine kullandığı ' fluxions ' gibi olması daha belirgin hale getiren 'hızla belirlenen' olmalıdır.
Akılar açısından, yukarıdaki ilk hesaplama kuralı yazılabilir.
nerede
- zamanı gösterir
- kalorimetrik malzemenin zaman içindeki ısınma hızını belirtir
- kalorimetrik malzemenin zaman içindeki hacminin zamana göre değişim oranını gösterir.
- kalorimetrik malzemenin sıcaklık değişiminin zamana bağlı oranını belirtir.
Artış ve akı , yukarıdaki kuralların sağ tarafındaki miktarların değerlerini belirleyen belirli bir süre için elde edilir . Ancak bu, matematiksel bir işlevin olması gerektiğini beklemek için bir neden değildir . Bu nedenle, artışa 'eksik diferansiyel' veya ' kesin olmayan diferansiyel ' denir . Bazı kitaplar bunu yazmak yerine yazarak gösterir . Ayrıca, bazı kitaplarda đQ işareti kullanılmaktadır. Bu konudaki dikkatsizlik hataya yol açabilir.
Miktarı uygun bir şekilde bir olduğu söylenir fonksiyonel sürekli eklem ilerlemesinin arasında ve bir matematiksel tanımında, ama fonksiyonu , bir fonksiyonu değildir . Akı burada zamanın bir fonksiyonu olarak tanımlansa da , semboller ve sırasıyla tek başına duranlar burada tanımlanmamıştır.
Yukarıdaki kalorimetri kurallarının fiziksel kapsamı
Yukarıdaki kurallar sadece uygun kalorimetrik malzemelerle ilgilidir. 'Hızlı' ve 'çok küçük' terimleri, yukarıdaki kuralların geçerlilik alanının ampirik fiziksel kontrolünü gerektirir.
Isı hesaplaması için yukarıdaki kurallar saf kalorimetriye aittir. Termodinamiğe atıfta bulunmazlar ve çoğunlukla termodinamiğin ortaya çıkmasından önce anlaşılmıştır. Termodinamiğe 'termo' katkının temelini oluştururlar. 'Dinamik' katkısı, yukarıdaki hesaplama kurallarında kullanılmayan iş fikrine dayanmaktadır .
Deneysel olarak uygun şekilde ölçülen katsayılar
Ampirik olarak, kalorimetrik malzemelerin özelliklerini deneysel olarak kontrol edilen koşullar altında ölçmek uygundur.
Sabit hacimde basınç artışı
Deneysel olarak kontrol edilen hacimdeki ölçümler için, yukarıda belirtilen, kalorimetrik malzeme gövdesinin basıncının, hacminin ve sıcaklığının bir fonksiyonu olarak ifade edilebileceği varsayımı kullanılabilir.
Deneysel olarak kontrol edilen sabit hacimde ölçüm için, sıcaklıkla birlikte basınç artışının izokorik katsayısı şu şekilde tanımlanır:
- .
Sabit basınçta genleşme
Deneysel olarak kontrol edilen basınçtaki ölçümler için , kalorimetrik malzeme gövdesinin hacminin , sıcaklığının ve basıncının bir fonksiyonu olarak ifade edilebileceği varsayılır . Bu varsayım, kalorimetrik malzeme gövdesinin basıncının, hacminin ve sıcaklığının bir fonksiyonu olarak bilindiği, yukarıda kullanılan varsayımla ilişkilidir, ancak bununla aynı değildir; malzemelerin anormal davranışı bu ilişkiyi etkileyebilir.
Sabit deneysel olarak kontrol edilen basınçta uygun şekilde ölçülen miktar, izobar hacim genleşme katsayısı ile tanımlanır.
- .
Sabit sıcaklıkta sıkıştırılabilirlik
Deneysel olarak kontrol edilen sıcaklıktaki ölçümler için, yine , kalorimetrik malzeme gövdesinin hacminin , hemen yukarıda belirtilen aynı koşullarla, sıcaklığının ve basıncının bir fonksiyonu olarak ifade edilebileceği varsayılır .
Deneysel olarak kontrol edilen sabit sıcaklıkta uygun şekilde ölçülen miktar, izotermal sıkıştırılabilirlik, şu şekilde tanımlanır:
- .
Klasik kalorimetrik miktarlar arasındaki ilişki
Kuralın bilindiğini varsayarak , klasik ısı hesabında yukarıda kullanılan fonksiyonun basınca göre türetilmesi mümkündür . Bu fonksiyon deneysel olarak katsayılardan ve matematiksel olarak çıkarsanabilir bağıntı yoluyla bulunabilir.
- .
Kalorimetri ve termodinamik arasındaki bağlantı
Termodinamik , on dokuzuncu yüzyılın ilk yarısında, daha önce üzerinde çalışılmış olan kalorimetri teorisine ve diğer keşiflere dayanarak kademeli olarak gelişti. Gislason ve Craig'e (2005) göre: "Termodinamik verilerin çoğu kalorimetriden gelir..." Kondepudi'ye (2008) göre: "Kalorimetri günümüz laboratuvarlarında yaygın olarak kullanılmaktadır."
Termodinamik açıdan, iç enerji kalorimetrik malzemenin bir fonksiyonun değerinin kabul edilebilir bir kısmi türev ile, ve .
Daha sonra, yukarıdaki kalorimetrik kuralların termodinamik bir versiyonunun yazılabileceği gösterilebilir:
ile
ve
- .
Yine, bundan başka termodinamik olarak, iç enerji kalorimetrik malzeme bazen kalorimetrik, malzemeye bağlı olarak bir fonksiyonun değerinin kabul edilebilir bir kısmi türev ile, ve , ile bir fonksiyonun değerinin eksprese olan bir , kısmi türevler ve .
Daha sonra, Adkins'e (1975) göre, yukarıdaki kalorimetrik kuralların bir başka termodinamik versiyonunun yazılabileceği gösterilebilir:
ile
ve
- .
Gizli ısının ve her zaman zıt işaretli olduğu yukarıda belirtilen kalorimetrik gerçeğin ötesinde, termodinamik iş kavramı kullanılarak gösterilebilir.
Termodinamiğin kalorimetriye özel ilgisi: Carnot döngüsünün izotermal bölümleri
Kalorimetrinin termodinamik için özel bir faydası vardır. Bir Carnot çevriminin izotermal bölümünde emilen veya yayılan ısıyı anlatır .
Carnot çevrimi, bir ısı motorunda kullanıma uygun malzemeden oluşan bir gövdeyi etkileyen özel bir çevrimsel işlem türüdür. Böyle bir malzeme, yukarıda belirtildiği gibi, sadece sıcaklık ve hacim tarafından çok hızlı bir şekilde belirlenen bir basınç uygulayan, kalorimetride kabul edilen türdendir. Böyle bir cismin tersinir olarak değiştiği söylenir. Bir Carnot çevrimi birbirini takip eden dört aşamadan veya bölümden oluşur:
(1) bir hacimden sabit sıcaklıktaki bir hacme , vücuda bir ısı akışı sağlamak için hacimde bir değişiklik (izotermal değişiklik olarak bilinir)
(2) Hacimde, ısı akışı olmayacak şekilde, değişken sıcaklıktaki bir hacme geçiş (adyabatik değişim olarak bilinir)
(3) sabit sıcaklıktaki bir hacme , vücuttan bir akış veya ısı oluşturacak ve tam olarak aşağıdaki değişime tam olarak hazırlanacak şekilde hacimde başka bir izotermal değişiklik
(4) 'ün hacminin bir adiyabatik değişimi için geri kendi başlangıç sıcaklığına gövde metni olarak sadece bu .
İzotermal segmentte (1), vücuda akan ısı ile verilir.
ve izotermal segmentte (3) vücuttan dışarı akan ısı ile verilir.
- .
(2) ve (4) segmentleri adiyabat olduğu için, bunlar sırasında vücuda herhangi bir ısı akışı olmaz ve sonuç olarak döngü sırasında vücuda verilen net ısı aşağıdaki gibidir:
- .
Bu miktar termodinamik tarafından kullanılır ve Carnot döngüsü sırasında vücut tarafından yapılan net işle özel bir şekilde ilişkilidir . Carnot döngüsü sırasında cismin iç enerjisinin net değişimi, sıfıra eşittir, çünkü çalışan cismin malzemesi yukarıda belirtilen özel özelliklere sahiptir.
Termodinamikte kalorimetrinin özel ilgisi: klasik kalorimetrik nicelikler arasındaki ilişkiler
Gizli ısının hacme göre ilişkisi ve hal denklemi
Miktar , hacme göre gizli ısı, klasik kalorimetriye aittir. Isının da aktarıldığı bir süreçte iş yoluyla enerji aktarımının meydana gelmesini açıklar; bununla birlikte miktar, ısı ve iş transferleri arasındaki ilişki termodinamiğin icadıyla açıklığa kavuşturulmadan önce düşünülmüştü. Termodinamiğin ışığında, klasik kalorimetrik niceliğin, kalorimetrik malzemenin durum denklemiyle sıkı bir şekilde bağlantılı olduğu ortaya çıkar . Sıcaklığın termodinamik mutlak ölçekte ölçülmesi şartıyla , ilişki formülde ifade edilir.
- .
Özgül ısı farkı
Gelişmiş termodinamik, ilişkiyi sağlar
- .
Bundan, daha fazla matematiksel ve termodinamik akıl yürütme, klasik kalorimetrik miktarlar arasında başka bir ilişkiye yol açar. Özgül ısıların farkı şu şekilde verilir:
- .
Termodinamik çalışmalar için pratik sabit hacimli kalorimetri (bomba kalorimetrisi)
Sabit hacimli kalorimetri, sabit bir hacimde gerçekleştirilen kalorimetridir . Bu, sabit hacimli bir kalorimetrenin kullanımını içerir .
Sabit hacimli kalorimetride hiçbir iş yapılmaz, bu nedenle ölçülen ısı sistemin iç enerjisindeki değişime eşittir. Sabit hacimdeki ısı kapasitesinin sıcaklıktan bağımsız olduğu varsayılır.
Isı, kalorimetri prensibi ile ölçülür.
nerede
- Δ U , iç enerjideki değişimdir ,
- Δ T sıcaklıktaki değişimdir ve
- C V , sabit hacimdeki ısı kapasitesidir .
Olarak sabit hacimli bir kalorimetre basınç sabit tutulur değildir. Başlangıç ve son durumlar arasında bir basınç farkı varsa, ölçülen ısının entalpi değişimini sağlamak için ayarlanması gerekir . Bir o zaman
nerede
- Δ H entalpideki değişimdir ve
- V , numune odasının değişmeyen hacmidir.
Ayrıca bakınız
- İzotermal mikrokalorimetri (IMC)
- İzotermal titrasyon kalorimetrisi
- Sorpsiyon kalorimetrisi
- reaksiyon kalorimetresi
Referanslar
Kitabın
- Adkins, CJ (1975). Equilibrium Thermodynamics , ikinci baskı, McGraw-Hill, Londra, ISBN 0-07-084057-1 .
- Bailyn, M. (1994). Termodinamik Araştırması , Amerikan Fizik Enstitüsü, New York, ISBN 0-88318-797-3 .
- Bryan, GH (1907). Termodinamik. Esas olarak İlk İlkeler ve Bunların Doğrudan Uygulamaları ile ilgili bir Giriş İncelemesi , BG Tuebner, Leipzig.
- Callen, HB (1960/1985). Termodinamik ve Termostatistiğe Giriş , ikinci baskı, Wiley, New York, ISBN 981-253-185-8 .
- Crawford, FH (1963). Isı, Termodinamik ve İstatistiksel Fizik , Rupert Hart-Davis, Londra, Harcourt, Brace ve Dünya.
- Guggenheim, EA (1949/1967). Termodinamik. Kimyagerler ve Fizikçiler için Gelişmiş Bir Tedavi , Kuzey Hollanda, Amsterdam.
- Iribarne, JV, Godson, WL (1973/1981), Atmosferik Termodinamik , ikinci baskı, D. Reidel, Kluwer Academic Publishers, Dordrecht, ISBN 90-277-1296-4 .
- Kondepudi, D. (2008). Modern Termodinamiğe Giriş , Wiley, Chichester, ISBN 978-0-470-01598-8 .
- Landsberg, PT (1978). Termodinamik ve İstatistiksel Mekanik , Oxford University Press, Oxford, ISBN 0-19-85142-6 .
- Lewis, GN, Randall, M. (1923/1961). Termodinamik , KS Pitzer, L. Brewer, McGraw-Hill, New York tarafından revize edilen ikinci baskı.
- Maxwell, JC (1872). Isı Teorisi , üçüncü baskı, Longmans, Green ve Co., Londra.
- Partington, JR (1949). Fiziksel Kimya Üzerine İleri Bir İnceleme , Cilt 1, Temel İlkeler. Gazların Özellikleri , Longmans, Green, and Co., Londra.
- Planck, M. (1923/1926). Treatise on Thermodynamics , A. Ogg tarafından çevrilen üçüncü İngilizce baskı, Longmans, Green & Co., London, yedinci Almanca baskıdan.
- Truesdell, C., Bharatha, S. (1977). S. Carnot ve F. Reech Tarafından Atılan Temel Üzerine Titizlikle İnşa Edilen Bir Isı Makineleri Teorisi Olarak Klasik Termodinamiğin Kavramları ve Mantığı , Springer, New York, ISBN 0-387-07971-8 .































































![\delta Q\ =\left [p(V,T)\,+\,\left.\frac{\kısmi U}{\kısmi V}\sağ|_{(V,T)}\sağ ]\, \delta V\,+\,\sol.\frac{\kısmi U}{\kısmi T}\sağ|_{(V,T)}\,\delta T](https://wikimedia.org/api/rest_v1/media/math/render/svg/f84955a4832939c4d1337fcfadae0affc3a945bc)








![\delta Q\ =\sol [\sol. \frac{\partial U}{\partial p}\sağ |_{(p,T)}\,+\,p \left.\frac{\partial V}{\partial p}\sağ |_{( p,T)}\sağ ]\delta p\,+\,\sol [ \sol.\frac{\kısmi U}{\kısmi T}\sağ|_{(p,T)}\,+\, p \sol.\frac{\kısmi V}{\kısmi T}\sağ |_{(p,T)}\sağ ]\delta T](https://wikimedia.org/api/rest_v1/media/math/render/svg/c80e88197ed385fd3debc25941f418cec98cd244)















![C_p(p,T)-C_V(V,T)=\left [p(V,T)\,+\,\left.\frac{\kısmi U}{\kısmi V}\sağ|_{(V) ,T)}\sağ ]\, \sol.\frac{\kısmi V}{\kısmi T}\sağ|_{(p,T)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e5046f626f9dccc1569d9c418d77d6cd6c0a06b)


