Brakiterapi - Brachytherapy
| Brakiterapi | |
|---|---|
 Ok, prostat kanserini tedavi etmek için kullanılan brakiterapi boncuklarını gösterir.
| |
| Diğer isimler | dahili radyoterapi, kapalı kaynaklı radyoterapi, küriterapi, endoküriterapi |
| ICD-10-PCS | D ?1 |
| ICD-9-CM | 92.27 |
| ağ | D001918 |
Brakiterapi , tedavi gerektiren alanın içine veya yanına kapalı bir radyasyon kaynağının yerleştirildiği bir radyasyon tedavisi şeklidir . Brachy olan Yunan kısaca. Brakiterapi yaygın olarak servikal , prostat , meme , yemek borusu ve cilt kanseri için etkili bir tedavi olarak kullanılır ve ayrıca vücudun diğer birçok bölgesindeki tümörleri tedavi etmek için kullanılabilir. Tedavi sonuçları, brakiterapinin kanser iyileştirme oranlarının ya cerrahi ve harici ışın radyoterapisi (EBRT) ile karşılaştırılabilir olduğunu ya da bu tekniklerle birlikte kullanıldığında iyileştiğini göstermiştir. Brakiterapi tek başına veya cerrahi, EBRT ve kemoterapi gibi diğer tedavilerle kombinasyon halinde kullanılabilir .
Brakiterapi , tahribat gerektiren dokuya kimyasal olarak lokalize olmak için vücuda terapötik bir radyonüklidin (radyoizotop) enjekte edildiği mühürsüz kaynak radyoterapi ile tezat oluşturur . Aynı zamanda, yüksek enerjili x-ışınlarının (veya bazen kobalt-60 gibi bir radyoizotoptan gelen gama ışınlarının ) vücudun dışından tümöre yönlendirildiği Dış Işın Radyasyon Tedavisi'nden (EBRT) de farklıdır . Bunun yerine brakiterapi, kısa menzilli radyasyon kaynaklarının (örneğin radyoizotoplar, iyodin-125 veya sezyum-131 ) doğrudan kanserli tümörün bulunduğu bölgeye tam olarak yerleştirilmesini içerir. Bunlar, çevredeki dokuyu tedavi etmek ve öldürmek için iyonlaştırıcı radyasyonun kaçmasına izin veren, ancak radyoizotop yükünün vücut sıvılarında hareket etmesini veya çözünmesini engelleyen koruyucu bir kapsül veya tel içinde bulunur. Kapsül daha sonra çıkarılabilir veya (bazı radyoizotoplarla) yerinde kalmasına izin verilebilir.
Brakiterapinin bir özelliği, ışınlamanın radyasyon kaynaklarının çevresinde sadece çok lokalize bir alanı etkilemesidir. Bu nedenle, kaynaklardan uzaktaki sağlıklı dokuların radyasyona maruz kalması azaltılır. Ayrıca tedavi sırasında hasta hareket ederse veya tümörün vücut içinde herhangi bir hareketi olursa radyasyon kaynakları tümöre göre doğru konumlarını korurlar. Brakiterapinin bu özellikleri EBRT'ye göre avantajlar sağlar - tümör, çevredeki sağlıklı dokulara gereksiz hasar olasılığını azaltırken çok yüksek dozlarda lokalize radyasyonla tedavi edilebilir.
Bir brakiterapi kürü, diğer radyoterapi tekniklerinden daha kısa sürede tamamlanabilir. Bu, hayatta kalan kanser hücrelerinin her bir radyoterapi dozu arasındaki aralıklarla bölünme ve büyüme şansını azaltmaya yardımcı olabilir. Hastalar tipik olarak EBRT'ye kıyasla radyoterapi kliniğine daha az ziyaret yapmak zorundadır ve tedaviyi ayaktan hasta olarak alabilirler. Bu, tedaviyi birçok hasta için erişilebilir ve uygun hale getirir. Brakiterapinin bu özellikleri, çoğu hastanın brakiterapi prosedürünü çok iyi tolere edebildiği anlamına gelir.
Küresel brakiterapi pazarı 2013 yılında 680 milyon ABD Dolarına ulaştı ve bunun %70'ini yüksek doz oranı (HDR) ve LDR segmentleri oluşturdu. Geri kalan %30'u mikroküreler ve elektronik brakiterapi oluşturuyordu. Bir analiz, brakiterapi pazarının 2030'da 2,4 milyar ABD Dolarını aşabileceğini ve esas olarak mikroküre pazarının yanı sıra kullanıcı dostu bir teknoloji olarak dünya çapında önemli bir ilgi gören elektronik brakiterapinin etkisiyle yıllık %8 büyüyeceğini tahmin ediyor.
Tıbbi kullanımlar
Brakiterapi yaygın olarak serviks , prostat , meme ve deri kanserlerini tedavi etmek için kullanılır .
Brakiterapi ayrıca beyin , göz , baş ve boyun bölgesi (dudak, ağız tabanı , dil, nazofarenks ve orofarenks ), solunum yolu ( trakea ve bronşlar ), sindirim sistemi ( yemek borusu , safra kesesi , safra kanalları , rektum , anüs ), idrar yolu ( mesane , üretra , penis ), kadın üreme sistemi ( uterus , vajina , vulva ) ve yumuşak dokular.
Radyasyon kaynakları tümör tedavi bölgesine tam olarak yerleştirilebildiğinden, brakiterapi küçük bir alana yüksek dozda radyasyon uygulanmasını sağlar. Ayrıca radyasyon kaynakları hedef tümörün içine veya yanına yerleştirildiğinden, hasta hareket ettiğinde veya tümörün vücutta herhangi bir hareketi olduğunda kaynaklar tümöre göre konumlarını korurlar. Bu nedenle, radyasyon kaynakları doğru bir şekilde hedeflenmiş olarak kalır. Bu, klinisyenlerin yüksek düzeyde bir doz uygunluğu elde etmelerini sağlar - yani tümörün tamamının optimal düzeyde radyasyon almasını sağlamak. Aynı zamanda, tümörün etrafındaki sağlıklı doku, organlar veya yapılara zarar verme riskini azaltır, böylece tedavi şansını ve organ fonksiyonunun korunmasını arttırır.
HDR brakiterapi kullanımı, EBRT'ye kıyasla genel tedavi sürelerinin azaltılmasını sağlar. Brakiterapi alan hastalar genellikle EBRT'ye kıyasla daha az radyoterapi ziyareti yapmak zorundadır ve genel radyoterapi tedavi planları daha kısa sürede tamamlanabilir. Birçok brakiterapi prosedürü ayaktan tedavi bazında gerçekleştirilir. Bu kolaylık, radyoterapi tedavisine erişebilmelerini ve tedavi planlarına uymalarını sağlamak için çalışmak zorunda olan hastalar, yaşlı hastalar veya tedavi merkezlerinden biraz uzakta yaşayan hastalar için özellikle önemli olabilir. Daha kısa tedavi süreleri ve ayakta tedavi prosedürleri, radyoterapi kliniklerinin verimliliğini artırmaya da yardımcı olabilir.
Brakiterapi, kanserin metastaz yapmamış (vücudun diğer bölgelerine yayılmamış) olmaması koşuluyla, küçük veya lokal olarak ilerlemiş tümörlerde kanseri tedavi etmek amacıyla kullanılabilir. Uygun şekilde seçilmiş vakalarda, primer tümörler için brakiterapi, genellikle aynı tedavi olasılığını ve benzer yan etkileri olan cerrahiye benzer bir yaklaşımı temsil eder. Bununla birlikte, lokal olarak ilerlemiş tümörlerde cerrahi, rutin olarak en iyi tedavi şansını sağlamayabilir ve çoğu zaman teknik olarak uygulanması mümkün değildir. Bu durumlarda, brakiterapi dahil olmak üzere radyoterapi, tek tedavi şansını sunar. Daha ileri hastalık evrelerinde, brakiterapi ağrı ve kanama semptomlarının giderilmesi için palyatif tedavi olarak kullanılabilir.
Tümörün kolayca erişilemediği veya tedavi alanına radyasyonun optimal dağılımını sağlamak için çok büyük olduğu durumlarda, brakiterapi EBRT ve/veya cerrahi gibi diğer tedavilerle birleştirilebilir. Brakiterapinin sadece kemoterapi ile kombinasyon tedavisi nadirdir.
Rahim ağzı kanseri
Brakiterapi, erken veya lokal olarak sınırlı rahim ağzı kanserinin tedavisinde yaygın olarak kullanılmaktadır ve birçok ülkede bir bakım standardıdır. Rahim ağzı kanseri LDR, PDR veya HDR brakiterapi ile tedavi edilebilir. EBRT ile birlikte kullanıldığında brakiterapi, tek başına EBRT'den daha iyi sonuçlar sağlayabilir. Brakiterapinin hassasiyeti, bitişik doku ve organlara radyasyon maruziyetini en aza indirirken, yüksek dozda hedeflenmiş radyasyonun servikse iletilmesini sağlar.
LDR, PDR ve HDR tedavileri için hastalıksız kalma (hastalıksız hayatta kalma) ve hayatta kalma (genel hayatta kalma) şansı benzerdir. Bununla birlikte, HDR tedavisinin önemli bir avantajı, her dozun ayakta tedavi bazında ve kısa bir uygulama süresiyle verilebilmesi ve birçok hasta için daha fazla kolaylık sağlamasıdır.
Araştırmalar, serviksin lokal olarak ilerlemiş karsinomasının harici ışın radyoterapisi (EBRT) ve kavite içi brakiterapi (ICBT) kombinasyonu ile tedavi edilmesi gerektiğini göstermektedir.
Prostat kanseri
Prostat kanserini tedavi etmek için brakiterapi, kalıcı LDR tohum implantasyonu veya geçici HDR brakiterapi olarak verilebilir.
Kalıcı tohum ekimi, lokalize tümörü ve iyi prognozu olan hastalar için uygundur ve kanserin geri dönmesini önlemek için oldukça etkili bir tedavi olduğu gösterilmiştir. Hayatta kalma oranı, EBRT veya cerrahi ( radikal prostatektomi ) ile bulunana benzer , ancak iktidarsızlık ve inkontinans gibi daha az yan etki ile . İşlem hızlı bir şekilde tamamlanabilir ve hastalar genellikle tedavinin aynı gününde evlerine gidebilir ve 1-2 gün sonra normal aktivitelerine dönebilir. Kalıcı tohum implantasyonu, prostatın cerrahi olarak çıkarılmasına kıyasla genellikle daha az invaziv bir tedavi seçeneğidir.
Geçici HDR brakiterapi, prostat kanserini tedavi etmek için daha yeni bir yaklaşımdır, ancak şu anda tohum implantasyonundan daha az yaygındır. Radyasyonu korurken prostat içindeki tümörün şekline uyan yüksek dozda radyasyon tedavisi vermek için alternatif bir yöntem sunduğundan, ağırlıklı olarak EBRT'ye ("artırma" tedavisi olarak bilinir) ek bir doz sağlamak için kullanılır. çevreleyen dokulara maruz kalma. Prostat kanseri için bir destek olarak HDR brakiterapi, EBRT seyrinin, EBRT'nin tek başına kullanılmasından daha kısa olabileceği anlamına da gelir.
Meme kanseri
Radyasyon tedavisi, lumpektomi veya mastektomi ameliyatı geçirmiş kadınlar için standart bakımdır ve meme koruyucu tedavinin ayrılmaz bir parçasıdır. Brakiterapi ameliyat sonrası, kemoterapi öncesi veya ilerlemiş hastalık durumunda palyatif olarak kullanılabilir. Meme kanserini tedavi etmek için brakiterapi genellikle HDR geçici brakiterapi ile yapılır. Ameliyat sonrası meme brakiterapisi, EBRT kullanılarak tüm meme ışınlamasının (WBI) ardından bir "destek" olarak kullanılabilir. Daha yakın zamanlarda, yalnızca orijinal tümörü çevreleyen bölgeye radyasyon verilmesini içeren APBI (hızlandırılmış kısmi meme ışınlaması) sağlamak için tek başına brakiterapi kullanılır.
Tüm meme ışınlamasına kıyasla meme brakiterapisinin ana yararı, sağlıklı meme dokularına ve kaburgalar ve akciğerler gibi alttaki yapılara radyasyondan kaçınırken, tümöre yüksek dozda radyasyonun hassas bir şekilde uygulanabilmesidir. APBI tipik olarak bir hafta boyunca tamamlanabilir. Brakiterapi seçeneği, çalışan kadınların, yaşlıların veya bir tedavi merkezine kolay erişimi olmayan kadınların, WBI ile karşılaştırıldığında (genellikle daha fazla ziyaret gerektiren) kısa tedavi kursu nedeniyle meme koruyucu tedaviden yararlanabilmelerini sağlamada özellikle önemli olabilir. 1-2 ay boyunca).
Göğüs brakiterapisini uygulamak için kullanılabilecek beş yöntem vardır: İnterstisyel meme brakiterapisi, İntrakaviter meme brakiterapisi, İntraoperatif radyasyon tedavisi, Kalıcı Meme Tohumu İmplantasyonu ve hedef lokalizasyon için mamografi ve bir HDR kaynağı kullanılarak invaziv olmayan meme brakiterapisi.
İnterstisyel meme brakiterapi
İnterstisyel meme brakiterapisi, meme dokusuna birkaç esnek plastik kateterin geçici olarak yerleştirilmesini içerir. Bunlar, çevreleyen meme dokusunu korurken tedavi alanına optimal radyasyon hedeflemesine izin vermek için dikkatlice konumlandırılmıştır. Kateterler , planlanan radyasyon dozunu tedavi alanına ileten bir art yükleyiciye bağlanır . İnterstisyel meme brakiterapisi, EBRT'den sonra "boost" veya APBI olarak kullanılabilir.
intraoperatif radyasyon tedavisi
İntraoperatif radyasyon tedavisi (IORT), tümörü çıkarma ameliyatı (lumpektomi) ile aynı anda radyasyon sağlar. Tümör çıkarıldıktan sonra kalan boşluğa bir aplikatör yerleştirilir ve mobil bir elektronik cihaz radyasyon (x-ışınları veya elektronlar) üretir ve bunu aplikatör aracılığıyla iletir. Radyasyon bir kerede verilir ve insizyonu kapatmadan önce aplikatör çıkarılır.
intrakaviter meme brakiterapi
İntrakaviter meme brakiterapisi ("balon brakiterapi" olarak da bilinir), tümörün çıkarılmasından (lumpektomi) sonra kalan meme boşluğuna tek bir kateter yerleştirilmesini içerir. Kateter, lumpektomi sırasında veya postoperatif olarak yerleştirilebilir. Kateter aracılığıyla, boşlukta bir balon şişirilir. Kateter daha sonra radyasyon dozunu kateterden balona ileten bir art yükleyiciye bağlanır . Günümüzde intrakaviter meme brakiterapisi sadece APBI için rutin olarak kullanılmaktadır.
Ayrıca interstisyel ve intrakaviter meme brakiterapisinin özelliklerini birleştiren cihazlar da vardır (örn. SAVI). Bu cihazlar birden fazla kateter kullanır ancak memedeki tek bir giriş noktasından sokulur. Çalışmalar, birden fazla kateter kullanımının doktorların radyasyonu daha hassas bir şekilde hedeflemesini sağladığını öne sürüyor.
Kalıcı meme tohumu implantasyonu
Kalıcı meme tohumu implantasyonu (PBSI), kalıcı tohum prostat brakiterapisine benzer şekilde, tümör bölgesini çevreleyen alanda meme içine birçok radyoaktif "tohum" (küçük topaklar) implante eder. Tohumlar 1-2 saatlik tek bir prosedürle ekilir ve sonraki aylarda içlerindeki radyoaktif madde bozuldukça radyasyon verir. İmplantlardan başkalarına (örneğin partner/eş) radyasyon riski araştırılmış ve güvenli olduğu bulunmuştur.
BEYİn tümörü
GamaTile Terapi olarak da bilinen Cerrahi Hedefli Radyasyon Tedavisi (START), özellikle beyin içinde kullanılmak üzere tasarlanmış yeni bir brakiterapi implantı türüdür. GammaTile, meningiomlar, metastazlar, yüksek dereceli gliomlar ve glioblastomlar dahil olmak üzere yeni teşhis edilmiş, ameliyat edilebilir malign intrakraniyal neoplazmaları (yani beyin tümörleri) ve ameliyat edilebilir tekrarlayan intrakraniyal neoplazmaları tedavi etmek için FDA onaylıdır.
Bir klinik çalışmada, GammaTile Therapy, yan etki riskinde artış olmadan önceki aynı bölge tedavilerine kıyasla lokal tümör kontrolünü iyileştirdi.
Yemek borusu kanseri
İçin özofagus kanseri radyasyon tedavisi, brakiterapi etkili tedavi için bir seçenektir, kesin radyoterapi (boost) veya palyatif tedaviler gerektirir. Kesin radyoterapi (boost) dozu tam olarak verebilir ve disfajiyi gidermek için palyatif tedaviler verilebilir. Büyük çaplı aplikatörler veya balon tipi kateter , yemek borusunu genişletmek ve yakındaki normal dokuyu koruyarak radyasyon dozunun tümöre iletilmesini kolaylaştırmak için afterloader ile birlikte kullanılır .
EBRT veya cerrahi sonrası brakiterapinin, EBRT veya sadece özofagus kanseri hastaları için cerrahiden daha sağkalım oranını ve lokal tekrarlama oranını iyileştirebileceği gösterilmiştir.
Cilt kanseri
Bazal hücreli karsinom ve skuamöz hücreli karsinom gibi melanomatöz olmayan cilt kanseri için HDR brakiterapi , cerrahiye alternatif bir tedavi seçeneği sunar. Bu, ameliyatın şekil bozukluğuna neden olabileceği veya kapsamlı bir rekonstrüksiyon gerektirebileceği burun, kulak, göz kapağı veya dudak kanserleri için özellikle önemlidir. Radyasyon kaynağı(lar) ile cilt arasında yakın teması sağlamak için cildin eğriliğine uyan ve optimum ışınlama dozunun hassas bir şekilde verilmesini sağlamaya yardımcı olan çeşitli aplikatörler kullanılabilir.
HDR ile benzer avantajlara sahip olan bir başka brakiterapi türü de Renyum-SCT ( Cilt Kanseri Tedavisi)'dir. Bu beta ışını emisyonu faydalanmak Renyum tedavi için -188 bazal hücreli veya - skuamöz hücreli karsinom . radyasyon kaynağı, doğrudan lezyonun üzerine ince bir koruyucu folyo uygulanan bir bileşik içine alınır. Bu şekilde radyasyon kaynağı karmaşık yerlere uygulanabilir ve sağlıklı dokuya radyasyonu en aza indirebilir.
Deri kanseri için brakiterapi, iyi kozmetik sonuçlar ve klinik etkinlik sağlar; 5 yıla kadar takip süresi olan çalışmalar, brakiterapinin lokal kontrol açısından oldukça etkili olduğunu ve EBRT ile karşılaştırılabilir olduğunu göstermiştir. Tedavi süreleri tipik olarak kısadır ve hastalara kolaylık sağlar. Brakiterapinin yakın gelecekte cilt kanseri için bir tedavi standardı haline gelebileceği öne sürülmüştür.
Kan damarları
Brakiterapi, kaynakların yerleştirildiği ve çıkarıldığı kan damarlarının içine bir kateter yerleştirildiği koroner stent içi restenoz tedavisinde kullanılabilir . Stent içi restenoz (ISR) tedavisinde İlaç Salınımlı stentlerin (DES) İntrakoroner Brakiterapiden (ICBT) daha üstün olduğu bulunmuştur. Bununla birlikte, başarısız stentlerde ve ven greftlerinde kalıcı restenoz için vasküler brakiterapiye ilgi devam etmektedir. Terapi ayrıca periferik vaskülatür stenozunun tedavisinde kullanım için araştırılmıştır ve atriyal fibrilasyonun tedavisi için düşünülmüştür .
Yan etkiler
Brakiterapi ile ilişkili potansiyel akut, subakut veya uzun vadeli yan etkilerin olasılığı ve doğası, tedavi edilen tümörün konumuna ve kullanılan brakiterapinin tipine bağlıdır.
Akut
Brakiterapi ile ilişkili akut yan etkiler, implante edilen bölgede lokalize morarma, şişme, kanama, akıntı veya rahatsızlığı içerir. Bunlar genellikle tedavinin tamamlanmasını takiben birkaç gün içinde düzelir. Hastalar ayrıca tedaviden sonra kısa bir süre yorgunluk hissedebilirler.
Rahim ağzı veya prostat kanseri için brakiterapi tedavisi, idrar retansiyonu, idrar kaçırma veya ağrılı idrara çıkma (dizüri) gibi akut ve geçici idrar semptomlarına neden olabilir. Geçici artan barsak sıklığı, ishal, kabızlık veya minör rektal kanama da meydana gelebilir. Akut ve subakut yan etkiler genellikle birkaç gün veya birkaç hafta içinde düzelir. Prostat kanseri için kalıcı (tohum) brakiterapi durumunda, bazı tohumların tedavi bölgesinden mesaneye veya üretraya göç etme ve idrarla geçme olasılığı çok düşüktür.
Deri kanseri için brakiterapi, tedaviyi takip eden haftalarda, tipik olarak 5-8 haftada iyileşen, tedavi alanı çevresinde derinin dış katmanlarının dökülmesine (deskuamasyon) neden olabilir. Kanser dudakta yerleşmişse brakiterapi sonucu ülserasyon meydana gelebilir, ancak genellikle 4-6 hafta sonra düzelir.
Brakiterapi ile ilişkili akut yan etkilerin çoğu ilaçla veya diyet değişiklikleri ile tedavi edilebilir ve genellikle tedavi tamamlandıktan sonra zamanla (tipik olarak birkaç hafta meselesi) kaybolur. HDR brakiterapinin akut yan etkileri EBRT'ye büyük ölçüde benzer.
uzun vadeli
Az sayıda insanda brakiterapi, bitişik doku veya organların hasar görmesi veya bozulması nedeniyle uzun süreli yan etkilere neden olabilir. Uzun vadeli yan etkiler genellikle hafif veya orta derecededir. Örneğin, servikal veya prostat kanseri için yapılan brakiterapinin bir sonucu olarak idrar ve sindirim sorunları devam edebilir ve sürekli tedavi gerektirebilir.
Prostat kanseri için brakiterapi, hastaların yaklaşık %15-30'unda erektil disfonksiyona neden olabilir. Bununla birlikte, erektil disfonksiyon riski yaşla (yaşlı erkekler genç erkeklere göre daha büyük risk altındadır) ve ayrıca brakiterapi almadan önceki erektil fonksiyonun seviyesiyle ilişkilidir. Erektil disfonksiyon yaşayan hastalarda vakaların çoğu Viagra gibi ilaçlarla başarılı bir şekilde tedavi edilebilir . Önemli olarak, brakiterapiden sonra erektil disfonksiyon riski radikal prostatektomiden sonra daha azdır .
Meme veya cilt kanseri için brakiterapi, tedavi alanı çevresinde skar dokusunun oluşmasına neden olabilir. Meme brakiterapisi durumunda yağ asitlerinin meme dokularına girmesi sonucu yağ nekrozu meydana gelebilir. Bu, meme dokusunun şişmesine ve hassaslaşmasına neden olabilir. Yağ nekrozu iyi huylu bir durumdur ve tipik olarak tedaviden 4-12 ay sonra ortaya çıkar ve hastaların yaklaşık %2'sini etkiler.
Diğerlerinin yanında güvenlik
Hastalar genellikle brakiterapi aldıktan sonra aile ve arkadaşlar çevresinde özel güvenlik önlemleri almaları gerekip gerekmediğini sorar. Geçici brakiterapi kullanılıyorsa tedaviden sonra vücutta radyoaktif kaynak kalmaz. Bu nedenle, yakın çevrede bulunan arkadaşlarınız veya aileniz için radyasyon riski yoktur.
Kalıcı brakiterapi kullanılıyorsa, tedaviden sonra vücutta düşük doz radyoaktif kaynaklar (tohumlar) kalır - radyasyon seviyeleri çok düşüktür ve zamanla azalır. Ek olarak, ışınlama radyoaktif kaynakların yalnızca birkaç milimetresi içindeki dokuları etkiler (yani tedavi edilen tümör). Bir önlem olarak, kalıcı brakiterapi alan bazı kişilere tedaviden sonra kısa bir süre küçük çocukları tutmamaları veya hamile kadınlara çok yakın olmamaları önerilebilir. Radyasyon onkoloğu veya hemşireleri hastalara özel talimatlar verebilir ve ne kadar süreyle dikkatli olmaları gerektiği konusunda tavsiyelerde bulunabilir.
Türler
(1) Radyasyon kaynaklarının hedef tedavi alanına yerleştirilmesine, (2) tümöre verilen radyasyon dozunun hızına veya 'yoğunluğuna' ve (3) dozun süresine göre farklı brakiterapi türleri tanımlanabilir . teslimat .
Kaynak yerleşimi
Radyoaktif kaynağın yerleştirilmesi açısından iki ana brakiterapi tedavisi türü, interstisyel ve temastır.
İnterstisyel brakiterapi durumunda, kaynaklar doğrudan prostat veya meme gibi etkilenen bölgenin hedef dokusuna yerleştirilir.
Kontak brakiterapi, radyasyon kaynağının hedef dokuya yakın bir alana yerleştirilmesini içerir. Bu boşluk serviks , rahim veya vajina gibi bir vücut boşluğu (intrakaviter brakiterapi) olabilir ; trakea veya yemek borusu gibi bir vücut lümeni (intraluminal brakiterapi) ; veya cilt gibi harici olarak (yüzey brakiterapi) . Koroner stent içi restenoz tedavisi için kan damarlarına (intravasküler brakiterapi) bir radyasyon kaynağı da yerleştirilebilir .
Doz oranı
Brakiterapinin doz hızı, radyasyonun çevreleyen ortama iletildiği seviye veya 'yoğunluk' anlamına gelir ve saat başına Grays (Gy/h) olarak ifade edilir .
Düşük doz hızı (LDR) brakiterapi, 2 Gy·h -1 hızına kadar radyasyon yayan radyasyon kaynaklarının implante edilmesini içerir . LDR brakiterapi, ağız boşluğu kanserleri, orofarenks , sarkomlar ve prostat kanseri için yaygın olarak kullanılır.
Orta doz hızı (MDR) brakiterapi, 2 Gy·s -1 ila 12 Gy·s -1 arasında değişen orta doz uygulama hızı ile karakterize edilir .
Doz verme oranı 12 saat Gy · aştığında yüksek doz oranı (HDR) brakiterapidir -1 . HDR brakiterapinin en yaygın uygulamaları serviks , yemek borusu , akciğerler , göğüsler ve prostat tümörlerindedir . Çoğu HDR tedavisi ayaktan tedavi bazında gerçekleştirilir, ancak bu, tedavi bölgesine bağlıdır.
Darbeli doz hızı (PDR) brakiterapi, LDR tedavisinin genel hızını ve etkinliğini simüle etmek için tipik olarak saatte bir kısa radyasyon darbeleri içerir. PDR brakiterapi ile tedavi edilen tipik tümör bölgeleri jinekolojik ve baş ve boyun kanserleridir.
Doz verme süresi
Radyasyon kaynaklarının hedef alana yerleştirilmesi geçici veya kalıcı olabilir.
Geçici brakiterapi, radyasyon kaynaklarının geri çekilmeden önce belirli bir süre (genellikle birkaç dakika veya saat) boyunca yerleştirilmesini içerir. Spesifik tedavi süresi, gerekli doz uygulama oranı ve kanserin tipi, boyutu ve yeri dahil olmak üzere birçok farklı faktöre bağlı olacaktır. LDR ve PDR brakiterapide kaynak, çıkarılmadan önce tipik olarak 24 saate kadar yerinde kalırken, HDR brakiterapide bu süre tipik olarak birkaç dakikadır.
Tohum implantasyonu olarak da bilinen kalıcı brakiterapi, tümör veya tedavi bölgesine küçük LDR radyoaktif tohumları veya peletleri (yaklaşık bir pirinç tanesi boyutunda) yerleştirmeyi ve bunları kalıcı olarak orada yavaş yavaş çürümek üzere bırakmayı içerir. Haftalar veya aylar boyunca, kaynakların yaydığı radyasyon seviyesi neredeyse sıfıra inecek. Aktif olmayan tohumlar daha sonra kalıcı bir etki olmadan tedavi bölgesinde kalır. Kalıcı brakiterapi en yaygın olarak prostat kanseri tedavisinde kullanılır .
prosedür
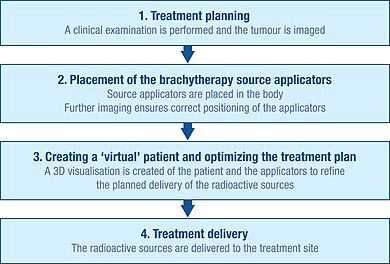
İlk planlama
Brakiterapi prosedürünü doğru bir şekilde planlamak için tümörün özelliklerini anlamak için kapsamlı bir klinik muayene yapılır. Ek olarak, tümörün şeklini ve boyutunu ve çevresindeki doku ve organlarla ilişkisini görselleştirmek için bir dizi görüntüleme yöntemi kullanılabilir. Bunlara x-ışını radyografisi, ultrason, bilgisayarlı aksiyal tomografi (CT veya CAT) taramaları ve manyetik rezonans görüntüleme (MRI) dahildir. Bu kaynakların birçoğundan elde edilen veriler, tümörün ve çevresindeki dokuların 3 boyutlu görselleştirmesini oluşturmak için kullanılabilir.
Bu bilgiyi kullanarak, radyasyon kaynaklarının optimal dağılımı için bir plan geliştirilebilir. Bu, radyasyonu tedavi bölgesine iletmek için kullanılan kaynak taşıyıcıların (aplikatörlerin) nasıl yerleştirilmesi ve konumlandırılması gerektiğinin değerlendirilmesini içerir. Aplikatörler radyoaktif değildir ve tipik olarak iğneler veya plastik kateterlerdir. Kullanılan spesifik aplikatör tipi, tedavi edilen kanser tipine ve hedef tümörün özelliklerine bağlı olacaktır.
Bu ilk planlama, sırasıyla tedavinin başarısızlığına ve yan etkilere neden olabileceğinden, tedavi sırasında 'soğuk noktalar' (çok az ışınlama) ve 'sıcak noktalardan' (çok fazla ışınlama) kaçınılmasını sağlamaya yardımcı olur.
sokma
Radyoaktif kaynaklar tümör bölgesine iletilmeden önce aplikatörlerin yerleştirilmesi ve ilk planlamaya göre doğru şekilde konumlandırılması gerekir.
Röntgen, floroskopi ve ultrason gibi görüntüleme teknikleri tipik olarak aplikatörlerin doğru pozisyonlarına yerleştirilmesine rehberlik etmek ve tedavi planını daha da iyileştirmek için kullanılır. CAT taramaları ve MRI da kullanılabilir. Aplikatörler yerleştirildikten sonra, hareket etmelerini önlemek için dikişler veya yapışkan bant kullanılarak cilde karşı yerinde tutulurlar. Aplikatörlerin doğru pozisyonda oldukları onaylandıktan sonra, ayrıntılı tedavi planlamasına rehberlik etmek için daha fazla görüntüleme yapılabilir.
Sanal hasta oluşturma
Aplikatörlerle birlikte hastanın görüntüleri, tedavi planlama yazılımına aktarılır ve hasta, tedavi için özel, korumalı bir odaya getirilir. Tedavi planlama yazılımı, tedavi bölgesinin birden fazla 2D görüntüsünün, içinde aplikatörlerin konumunun tanımlanabileceği bir 3D 'sanal hastaya' dönüştürülmesini sağlar. Bu 'sanal hasta' içindeki aplikatörler, tedavi bölgesi ve çevreleyen sağlıklı dokular arasındaki uzamsal ilişkiler, gerçek hastadaki ilişkilerin bir kopyasıdır.
Işınlama planının optimize edilmesi
İmplante edilen doku veya boşluğun uygulayıcıları içinde radyasyon kaynaklarının optimal uzamsal ve zamansal dağılımını belirlemek için, tedavi planlama yazılımı sanal radyasyon kaynaklarının sanal hastaya yerleştirilmesine izin verir. Yazılım, ışınlama dağılımının grafiksel bir temsilini gösterir. Bu, brakiterapi ekibine, kaynakların dağılımını iyileştirmesi ve ışınlamanın fiili iletilmesi başlamadan önce her hastanın anatomisine en uygun şekilde uyarlanmış bir tedavi planı sağlaması için bir kılavuz görevi görür. Bu yaklaşıma bazen 'doz boyama' denir.
Tedavi teslimatı
Brakiterapi için kullanılan radyasyon kaynakları her zaman radyoaktif olmayan bir kapsül içinde bulunur. Kaynaklar manuel olarak iletilebilir, ancak daha yaygın olarak 'sonradan yükleme' olarak bilinen bir teknikle iletilir.
Klinik personelin radyasyona maruz kalma riski nedeniyle brakiterapinin manuel olarak verilmesi birkaç LDR uygulamasıyla sınırlıdır.
Buna karşılık, sonradan yükleme, tedavi bölgesinde radyoaktif olmayan aplikatörlerin doğru konumlandırılmasını içerir ve bunlar daha sonra radyasyon kaynakları ile yüklenir. Manuel sonradan yüklemede kaynak, operatör tarafından aplikatöre iletilir.
Uzaktan sonradan yükleme sistemleri, radyasyon kaynağını korumalı bir kasada güvenceye alarak sağlık profesyonellerinin radyasyona maruz kalmasına karşı koruma sağlar. Aplikatörler hastaya doğru bir şekilde yerleştirildikten sonra, bir dizi bağlantı kılavuz tüpü aracılığıyla bir "sonradan yükleyici" makinesine (radyoaktif kaynakları içeren) bağlanırlar. Tedavi planı, daha sonra kılavuz tüpler boyunca kaynakların aplikatör içinde önceden belirlenmiş konumlara iletilmesini kontrol eden son yükleyiciye gönderilir. Bu süreç, ancak personel tedavi odasından çıkarıldıktan sonra devreye girer. Kaynaklar, önceden belirlenmiş bir süre boyunca yerinde kalır, ardından yine tedavi planını takip eder ve ardından tüpler boyunca son yükleyiciye geri gönderilir.
Radyoaktif kaynakların dağıtımı tamamlandıktan sonra aplikatörler dikkatlice vücuttan çıkarılır. Hastalar tipik olarak brakiterapi prosedüründen hızlı bir şekilde iyileşir ve bu da genellikle ayakta tedavi bazında gerçekleştirilmesini sağlar.
2003 ve 2012 yılları arasında Amerika Birleşik Devletleri toplum hastanelerinde, brakiterapi (dahili radyasyon tedavisi) ile hastanede kalış oranı, 45-64 yaşındaki yetişkinler arasında yıllık ortalama yüzde 24,4 ve 65-84 yaşındaki yetişkinler arasında yıllık ortalama yüzde 27.3 düşüşe sahipti. . Brakiterapi, Medicare ve özel sigorta tarafından ödenen hastane yatışları arasında en büyük değişiklik gösteren ameliyathane prosedürüydü.
radyasyon kaynakları
Brakiterapi için yaygın olarak kullanılan radyasyon kaynakları (radyonükleidler).
| radyonüklid | Tip | Yarım hayat | Enerji |
|---|---|---|---|
| Sezyum-131 ( 131 Cs) | Elektron Yakalama, ε | 9.7 gün | 30,4 keV (ortalama) |
| Sezyum-137 ( 137 Cs) | β - - parçacıklar, γ-ışınları | 30.17 yıl | 0.512, 0.662 MeV gama ışınları |
| Kobalt-60 ( 60 Co) | β - - parçacıklar, γ-ışınları | 5.26 yıl | 1.17, 1.33 MeV gama ışınları |
| İridyum-192 ( 192 Ir) | γ-ışınları | 73.8 gün | 0.38 MeV (ortalama) |
| İyot-125 ( 125 I) | Elektron Yakalama, ε | 59.6 gün | 27,4, 31,4 ve 35.5 keV |
| Paladyum-103 ( 103 Pd) | Elektron Yakalama, ε | 17.0 gün | 21 keV (ortalama) |
| Rutenyum-106 ( 106 Ru) | β - - parçacıklar | 1.02 yıl | 3.54 MeV |
| Radyum-226 ( 226 Ra) | α- parçacıklar | 1599 yıl |
Tarih
Brakiterapi , Pierre Curie'nin Henri-Alexandre Danlos'a bir radyoaktif kaynağın bir tümöre yerleştirilebileceğini önerdiği 1901 yılına ( 1896'da Henri Becquerel tarafından radyoaktivitenin keşfinden kısa bir süre sonra) kadar uzanır . Radyasyonun tümörün küçülmesine neden olduğu bulundu. Bağımsız olarak, Alexander Graham Bell de radyasyonun bu şekilde kullanılmasını önerdi. Yirminci yüzyılın başlarında, brakiterapi uygulama teknikleri Paris'teki Curie enstitüsünde Danlos tarafından ve New York'taki St Luke's ve Memorial Hastanesinde Robert Abbe tarafından öncülük edildi .
Paris Üniversitesi'ndeki radyum araştırma laboratuvarlarında Curies ile birlikte çalışan Amerikalı fizikçi William Duane , radyum sülfat çözeltilerinden radon-222 gazını çıkarmak için bir teknik geliştirdi. 1 gram radyum içeren çözeltiler, her biri yaklaşık 20 milikürilik radon "tohumları" oluşturmak için "sağıldı". Bu "tohumlar", endoküriterapi adı verilen erken bir brakiterapi biçiminde kullanılmak üzere Paris'e dağıtıldı. Duane, Paris'te geçirdiği süre boyunca bu "sağım" tekniğini mükemmelleştirdi ve cihaza "radyum ineği" adını verdi.
Duane, 1913'te Amerika Birleşik Devletleri'ne döndü ve Harvard'da fizik yardımcı doçenti ve Harvard Kanser Komisyonu'nda Fizik Araştırma Görevlisi olarak ortak bir rolde çalıştı. Kanser Komisyonu 1901'de kuruldu ve kanser tedavisinde radyum yayılımlarının kullanımını araştırmak için Duane'i tuttu. 1915'te Boston'un ilk "radyum ineği"ni yaptı ve binlerce hasta ondan üretilen radon-222 ile tedavi edildi.
İnterstisyel radyum tedavisi 1930'larda yaygındı. İle dolu altın tohumları radon en az 1958 yılına kadar erken 1942 olarak kullanıldı Altın kabukları kalkan 1920 civarında Gino Failla tarafından seçilmiştir beta ışınları geçerken gama ışınları . Kobalt iğneleri de İkinci Dünya Savaşı'ndan kısa bir süre sonra kullanıldı. İridyum ön plana çıkmadan önce radon ve kobaltın yerini radyoaktif tantal ve altın aldı. İlk olarak 1958'de kullanılan iridyum, günümüzde brakiterapi için en yaygın kullanılan yapay kaynaktır.
Avrupa ve ABD'de brakiterapiye ilk ilgiyi takiben, radyoaktif kaynakların manuel olarak uygulanmasından operatörlerin radyasyona maruz kalması sorunu nedeniyle kullanımı yirminci yüzyılın ortalarında azaldı. Ancak 1950'lerde ve 1960'larda radyasyonun korumalı bir kasadan iletilmesine izin veren uzaktan yükleme sistemlerinin geliştirilmesi ve yeni radyoaktif kaynakların kullanılması, operatör ve hastaların gereksiz radyasyona maruz kalma riskini azaltmıştır. Bu, üç boyutlu görüntüleme modalitelerindeki son gelişmeler, bilgisayarlı tedavi planlama sistemleri ve uygulama ekipmanı ile birlikte brakiterapiyi günümüzde birçok kanser türü için güvenli ve etkili bir tedavi haline getirmiştir.
"Brakiterapi" kelimesi , "kısa mesafe" veya "kısa" anlamına gelen Yunanca βραχύς brachys kelimesinden gelir .
Çevresel tehlike
Brakiterapi kaynaklarının küçük boyutu ve erken onyıllardaki düşük kontrol nedeniyle, bunlardan bazılarının çevreye kaçarak öksüz kaynaklar haline gelme riski vardır . 2011 yılında Prag oyun alanında bir metre uzaklıktan 500 µSv/h yayan bir radyum iğnesi bulundu.
Ayrıca bakınız
- Dış ışın radyoterapi
- prostat brakiterapi
- Hedeflenen intraoperatif radyoterapi
- Mühürsüz kaynak radyoterapi
- Nükleer Tıp
- intraoperatif radyasyon tedavisi
- Temaslı X-ray brakiterapi ("elektronik brakiterapi" olarak da bilinir)
Referanslar
Dış bağlantılar