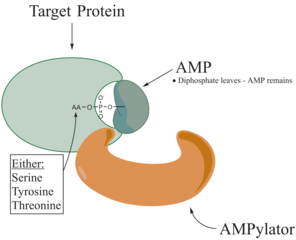
Adenilasyon - Adenylylation
Adenylylation , daha yaygın olarak bilinen AMPylation , bir olan bir işlemdir adenosin monofosfat (AMP) molekülü kovalent olarak bağlı olan bir amino asit , bir yan zincir proteini . AMP'nin proteinin bir hidroksil yan zincirine bu kovalent ilavesi, translasyon sonrası bir modifikasyondur . Adenilasyon, adenilasyona uğrayan molekülün bir hidroksil grubu ile adenosin monofosfat nükleotidinin (yani adenilik asit) fosfat grubu arasındaki bir fosfodiester bağını içerir . Bu işlemi katalize edebilen enzimlere AMPilatörler denir.
Proteinde hedeflendiği bilinen amino asitler, tirozin ve treonin ve bazen de serindir. Bir protein üzerindeki yükler bir değişikliğe uğradığında, normalde proteini oluşturan amino asitlerin etkileşimleri yoluyla şeklini değiştirerek proteinin özelliklerini etkiler. AMPilasyonun protein üzerinde çeşitli etkileri olabilir. Bunlar, proteinin özellikleri, stabilitesi, enzimatik aktivitesi, kofaktör bağlanması ve bir proteinin diğer birçok fonksiyonel yeteneğidir. Adenilasyonun başka bir işlevi, tRNA aminoasil sentetaz tarafından katalize edilen amino asit aktivasyonudur. AMPilasyonu almak için en yaygın olarak tanımlanan protein, GTPazlar ve glutamin sentetazdır .
Adenilatatörler
AMPilatörler veya Adenililtransferaz olarak adlandırılan AMPilasyondan sorumlu enzimler , tümü yapısal özelliklerine ve kullanılan mekanizmaya bağlı olarak iki farklı aileye ayrılır. AMPilatör, iki katalitik homolog yarı tarafından oluşturulur. Bir yarısı adenilasyon reaksiyonunu katalize etmekten sorumludur, diğer yarısı ise fosforolitik deadenilasyon reaksiyonunu katalize eder . Bu iki aile, DNA - β -polimeraz benzeri ve Fic ailesidir.
DNA- β -polimeraz benzeri, bir Nükleotidiltransferaz ailesidir . Daha spesifik olarak GlnE ailesi olarak bilinir. Bu özel aileyi açıklığa kavuşturmak için kullanılan belirli bir motif vardır. Motif, magnezyum iyon koordinasyonunun ve fosfat bağlanmasının bir parçası olan üç iplikli bir β-tabakadan oluşur. Bu ailede aktivitenin gerçekleşmesi için aspartat gereklidir.
Fic alanı , siklik AMP alanı tarafından indüklenen bir filamentasyon olan Fido (Fic/Doc) superfamily Fic ailesine aittir , AMPilasyon gerçekleştirdiği bilinmektedir. Bu protein ailesi, dünyadaki yaşamın tüm alanlarında bulunur. ATP-bağlanma bölgesi alfa sarmal motifinin bir mekanizması aracılığıyla aracılık edilir. Enfeksiyöz bakteriler bu alanı fagositozu kesmek ve hücre ölümüne neden olmak için kullanır. Fic alanları , Fido alanı süper ailesine ait olan prokaryotlarda ve ökaryotlarda evrimsel olarak korunan alanlardır .
AMPilatörlerin, ATP hidroliz aktiviteleri ve metabolitin protein substratının bir hidroksil yan zincirine tersinir transferinden dolayı kinazlarla karşılaştırılabilir olduğu gösterilmiştir. Bununla birlikte, AMPilasyon, a-fosfat grubu üzerinde bir nükleofilik saldırıyı katalize ederken, fosforilasyon reaksiyonundaki kinaz, y-fosfatı hedefler. AMPilasyonun nükleofilik saldırısı, Pirofosfatın salınmasına yol açar ve AMP ile modifiye edilmiş protein, AMPilasyon reaksiyonunun ürünleridir.
De-adenililatörler
De-AMPilasyon, AMP molekülünün bir zincir proteininin amino asit tarafından ayrıldığı ters reaksiyondur.
Bu reaksiyon için bilinen üç mekanizma vardır. Bakteriyel GS-ATase (GlnE), aktivitesi P II ve ilişkili translasyon sonrası modifikasyonlar tarafından düzenlenen ayrı N-terminal AMPilasyon ve C-terminal de-AMPilasyon alanlarına sahip iki parçalı bir proteini kodlar . Substratının de-AMPilasyonu AMPillenmiş glutamin sentetaz , GS'nin adenil-tirozini ile ortofosfat arasındaki fosforolitik reaksiyon ile ilerleyerek ADP ve modifiye edilmemiş glutamin sentetaz oluşumuna yol açar.
Patojenik bakteri Legionella pneumophila tarafından konakçı hücreye sokulan bir protein olan SidD, Rab1'i farklı bir Legionella pneumophila enzimi, AMPylase SidM tarafından AMPile edilmiş bir konak proteini de-AMPile eder. Bu iki antagonistik efektörün konakçıya dahil edilmesinin patojene faydası belirsizliğini koruyor olsa da, SidD tarafından gerçekleştirilen biyokimyasal reaksiyon, AMP'nin konakçının Rab1'inin tirozin 77'sinden hidrolitik olarak çıkarılmasını katalize etmek için fosfataz benzeri bir alanın kullanımını içerir.
Hayvan hücrelerinde BiP/Grp78'in treonin 518'inden AMP'nin çıkarılması, BiP'yi AMPile eden aynı enzim, FICD tarafından katalize edilir. Bakteriyel GS-ATase'den farklı olarak FICD, her iki reaksiyonu da aynı katalitik alanla gerçekleştirir.
prokaryotik
Bakteriyel homeostazı
AMPilasyon bakteriyel homeostazda yer alır. En ünlü örnek, AMPilasyon ve DeAMPilasyon bölümlerinde tanıtılan glutamin sentetazın AMPilasyonu yoluyla nitrojen metabolizmasının karmaşık düzenlenmesine katkıda bulunan AMPilatör GS-ATase'dir (GlnE).
Bakteriyel homeostazda rol oynayan başka bir AMPilatör örneği, Topoizomeraz IV'te ParE alt biriminin ATP bağlanması için korunmuş tirozin tortusu olan DNA girazın GyrB alt birimini değiştiren sınıf I Fic AMPilatörlerdir (FicT). AMPilasyon yoluyla bu DNA giraz inaktivasyonu, DNA hasarına hücresel yanıt olan SOS yanıtının aktivasyonuna yol açar. FicT AMPylation aktivitesi tersine çevrilebilir ve sadece büyümenin durmasına yol açar, hücre ölümüne yol açmaz. Bu nedenle, FicT AMPilasyonu, Wolbachia bakterilerinde doksisikline yanıt olarak FicT seviyesinin arttığı gösterilen hücre stresinin düzenlenmesinde rol oynar.
N. meningtidis'in bir Sınıf III Fic AMPilatör NmFic'inin, ATP bağlanması için korunmuş tirozinde AMPilat GyrB'yi değiştirdiği de bulunmuştur. Bu, AMPilasyonun bakterilerde hücresel stresi düzenlemedeki önemli rolünü gösteren Fic alanlarının yüksek oranda korunduğunu gösterir. NmFic'in düzenlenmesi, NmFic aktivitesinin aktivasyonu için konsantrasyona bağlı monomerizasyon ve otoAMPilasyonu içerir.
Bakteriyel patojenite
Efektörler olarak da bilinen bakteri proteinlerinin AMPilasyonu kullandığı gösterilmiştir. VopS, IbpA ve DrrA gibi efektörlerin, GTPazları AMPile ettiği ve aktin hücre iskeleti değişikliklerine neden olduğu gösterilmiştir. GTPazlar , AMPilatörlerin ortak hedefleridir. Rho , Rab ve Arf GTPaz aileleri, aktin hücre iskeleti dinamikleri ve veziküler kaçakçılığında yer alır. Ayrıca konak hücrede fagositoz gibi hücresel kontrol mekanizmalarında da rol oynarlar .
Patojen ya uyarılması ya da engellenmesi konakçı hücre fagositozla geliştirir veya önleyen internalizasyonu . Vibrio parahaemolyticus , insanlarda çiğ veya az pişmiş deniz ürünleri tüketimi sonucu gıda zehirlenmesine neden olan Gram negatif bir bakteridir. Vibrio parahaemolyticus'ta bulunan bir tip III efektör olan VopS, AMPilasyon için gerekli bir histidin kalıntısı içeren korunmuş bir HPFx(D/E)GN(G/K)R motifine sahip bir Fic alanı içerir. VopS, Rho GTPaz'ların anahtar 1 bölgesindeki treonin kalıntısını değiştirerek aktin düzeneğini bloke eder. ATP kullanılarak bir AMP parçasının treonin tortusuna transferi, sterik engelleme ile sonuçlanır ve böylece Rho GTPaz'ların akış aşağı efektörlerle etkileşime girmesini önler. VopS ayrıca RhoA ve hücre bölünme döngüsü 42'yi (CDC42) adenile ederek aktin filament ağının ayrışmasına yol açar. Sonuç olarak, konak hücrenin aktin hücre iskeleti kontrolü devre dışı bırakılır ve hücre yuvarlanmasına yol açar.
IbpA, sığırlarda solunum yolu epitel enfeksiyonuna neden olan Gram negatif bir bakteri olan H. somni'den ökaryotik hücrelere salgılanır . Bu efektör, C-terminal bölgesinde iki Fic alanı içerir. Rho ailesi GTPazlarının IbpA Fic alanının AMPilasyonu, sitotoksisitesinden sorumludur. Her iki Fic alanı, konakçı hücrelerin hücre iskeleti üzerinde VopS ile benzer etkilere sahiptir. Anahtar 1 bölgesinin bir tirozin tortusu üzerindeki AMPilasyon, GTPazların PAK gibi aşağı akış substratları ile etkileşimini bloke eder.
DrrA, Legionella pneumophila'dan Dot/Icm tip IV translokasyon sistemi substratı DrrA'dır . L. pneumophila tarafından konakçı hücrelerin GTPaz'larını modifiye etmek için salgılanan efektördür. Bu modifikasyon, konakçı hücrelerde bakterilerin hayatta kalmasını arttırır. DrrA, Rab1b'ye özgü guanin nükleotid değişim faktörü (GEF) alanından, bir C-terminal lipid bağlama alanından ve belirsiz sitotoksik özelliklere sahip bir N-terminal alanından oluşur. Araştırma çalışmaları, N-terminali ve tam uzunluktaki DrrA'nın, aynı zamanda Rab1b GEF alanının substratı olan konakçının Rab1b proteinine (Ras ile ilgili protein) karşı AMPilatör aktivitesi gösterdiğini göstermektedir. Rab1b proteini, vezikül taşınmasını ve membran füzyonunu düzenleyen GTPase Rab'dir. Bakteri AMPilatörleri tarafından adenilasyon, Rab1b'nin GTP'ye bağlı durumunu uzatır. Bu nedenle, efektör DrrA'nın rolü, enfeksiyon sırasında replikasyonları için bakteri vakuollerinin yararları ile bağlantılıdır.
ökaryotik
Bitkiler ve mayalar bilinen endojen AMPilleme enzimlerine sahip değildir, ancak hayvan genomları, muhtemelen bir prokaryottan yatay gen transferi yoluyla hayvanların erken bir atası tarafından edinilmiş olan bir Fic alan AMPilazını kodlayan bir genin tek bir kopyasına sahiptir . Yaygın olarak FICD olarak adlandırılan insan proteini, daha önce Huntingtin ile ilişkili protein E olarak tanımlanmıştı (HypE; bir maya iki-hibrit elemesinden kaynaklanan bir atama, ancak Huntingtin ve HypE/FICD farklı hücresel bölmelerde lokalize olduğundan , uygunluğu şüphelidir) . Drosophila melanogaster (CG9523) ve C. elegans (Fic-1) içindeki CG9523 Homologları da dikkat çekmiştir. Tüm hayvanlarda FICD benzer bir yapıya sahiptir. Kısa bir sitoplazmik alan ve ardından proteini endoplazmik retikulumda (ER) tutan membran çapa ve ER'de bulunan ve tetratrikopeptit tekrarlarını (TPR'ler) kapsayan uzun C-terminal kısmı olan bir tip II transmembran alan proteinidir, ardından bir katalitik Fic alanı.
Endoplazmik retikulum
Bir hayvan hücresi AMPilazının keşfi, ardından ER lokalizasyonunun keşfi ve BiP'nin aktivitesi için önde gelen bir substrat olduğu önemli atılımlardı. BiP'nin (Grp78 olarak da bilinir) uzun süredir inaktive edici bir post-translasyonel modifikasyona uğradığı biliniyordu, ancak doğası hala zor. Yaygın olarak ADP-ribosilasyon olduğu varsayılır , hücrelerde FICD geninin inaktive edilmesi BiP'nin tüm ölçülebilir translasyon sonrası modifikasyonunu ortadan kaldırdığı için FICD aracılı AMPilasyon olduğu ortaya çıkar.
BiP, aktivitesi, Katlanmamış Protein Tepkisi (UPR) olarak bilinen bir gen ekspresyon programı aracılığıyla transkripsiyonel seviyede sıkı bir şekilde düzenlenen ER-lokalize bir protein şaperondur . EPD a, homeostatik yardım ER (sözde ER stresi) içerisinde katlanmamış proteinleri yükü çiftler Bip (ve birçok başka protein) transkripsiyon oranı ER korumak işlem proteostasis . AMPilasyon, BiP'nin substrat bağlama alanının Thr518'inin bir AMP ile modifikasyonu şaperonu aktif olmayan bir konformasyona kilitlediğinden, BiP'nin aktivitesinin başka bir hızlı translasyon sonrası kontrol katmanı ekler. Bu değişiklik, fazla BiP'yi etkisiz hale getirmek için ER stresi azaldıkça seçici olarak dağıtılır. Bununla birlikte, ER stresi tekrar yükseldiğinde, aynı enzim, FICD, zıt reaksiyonu, BiP de-AMPilasyonunu katalize eder.
BiP AMPilasyonunun ve de-AMPilasyonunun yapısal temelinin anlaşılması, FICD'nin aktivitesindeki değişimi düzenleyebilecek allosteriye ilişkin ipuçları gibi yavaş yavaş ortaya çıkmaktadır, ancak bu sürecin hücrelerde meydana geldiği gibi önemli detayları keşfedilmeyi beklemektedir.
FICD'nin Thr518 üzerinde BiP AMPilasyonunda (ve de-AMPilasyonunda) rolü, biyokimyasal ve yapısal çalışmalarla iyi bir şekilde desteklenmektedir. Bazı durumlarda FICD'nin BiP'nin nükleotid bağlanma alanında farklı bir tortuyu, Thr366'yı AMPile edebileceğine dair kanıtlar da sunulmuştur.
Caenorhabditis elegans
Fic-1, C. elegans'ın genetik kodunda bulunan tek Fic proteinidir . Esas olarak yetişkin germ hattı hücrelerinin ve embriyotik hücrelerin ER nükleer zarfında bulunur , ancak sitoplazmada küçük miktarlar bulunabilir. FICD's-1'in bu ekstra ER havuzu, nematod içindeki çekirdek histonların ve eEF1-A tipi translasyon faktörlerinin AMPilasyonu ile kredilendirilir .
Değişen AMPilasyon seviyeleri, nematodun davranışı veya fizyolojisi içinde gözle görülür herhangi bir etki yaratmasa da, Fic-1 nakavt solucanları, aktif Fic-1 alanlarına sahip muadillerine kıyasla Pseudomonas aeruginosa tarafından enfeksiyona karşı daha duyarlıydı , bu da hücresel hedeflerin AMPilasyonu arasında bir bağlantı anlamına geliyordu. nematodlar içinde bağışıklık tepkileri.
Drosophila melanogaster
FICD'de (CG9523) eksik olan sinekler kör olarak tanımlanmıştır. Başlangıçta, bu kusur, kişi projeksiyonlarının hücre yüzeyindeki FICD'nin bir rolüne bağlandı - varsayılan bir nörotransmiter geri dönüşüm bölgesi, ancak daha sonraki bir çalışma, BiP Thr366'nın FICD aracılı AMPilasyonunu görsel probleme dahil etti.
klinik önemi
Presinaptik protein a-sinükleinin , FICD AMPilasyonu için bir hedef olduğu bulundu. αSyn'in HypE aracılı adenilasyonu sırasında, αSyn agregasyonu azalır ve hem nörotoksisite hem de ER stresinin in vitro olarak azaldığı keşfedilmiştir . Bu nedenle, αSyn'in adenilasyonu muhtemelen ER stresine ve αSyn agregasyonuna karşı koruyucu bir yanıttır. Bununla birlikte, aSyn ve FICD farklı bölümlerde bulunduğundan, bu iddiaların önemini doğrulamak için daha fazla araştırma yapılması gerekmektedir.
Tespit etme
Kimyasal kulplar
Kimyasal tutamaçlar, çeviri sonrası modifiye edilmiş proteinleri tespit etmek için kullanılır. Son zamanlarda, ATP'nin adenininin N6 pozisyonunda bir alkinil etiketi (propargil) içeren bir N6pATP vardır. Bu N6pATP, AMPillenmiş proteinleri tespit etmek için tıklama reaksiyonu ile birleşir. Tanınmayan değiştirilmiş proteini tespit etmek ve VopS substratlarını etiketlemek için, bunu yapmak için adenin N6 NH2'de bir floroforlu ATP türevleri kullanılır.
Antikor bazlı yöntem
Antikor, yüksek afinitesi ve seçiciliği ile ünlüdür, bu nedenle AMPillenmiş proteinleri tespit etmenin iyi bir yoludur. Son zamanlarda, ɑ-AMP antikorları, AMPillenmiş proteinleri (özellikle AMPillenmiş tirozin ve AMPillenmiş treonin) hücrelerden ve hücre lizatlarından doğrudan saptamak ve izole etmek için kullanılır. AMPilasyon, translasyon sonrası bir modifikasyondur, bu nedenle AMP ve hidrofobikliğin polar karakterini vererek protein özelliklerini değiştirecektir. Bu nedenle, bütün bir peptit dizisini saptayan antikorlar kullanmak yerine, doğrudan spesifik amino asitlere hedeflenen AMP antikorlarının yükseltilmesi tercih edilir.
Kütle spektrometrisi
Daha önce, birçok bilim çalışması, AMPile edilmiş peptitleri tespit etmek için farklı parçalanma modlarında Kütle Spektrometresi (MS) kullanıyordu. Ayırt edici parçalanma tekniklerine yanıt olarak, AMPile protein dizileri, AMP'nin farklı bölümlerinde parçalandı. Elektron transfer ayrışması (ETD) minimum fragmanlar ve daha az karmaşık spektrumlar yaratırken, çarpışma kaynaklı ayrışma (CID) ve yüksek enerjili çarpışma (HCD) fragmantasyonu, çoklu AMP fragmanları üreterek AMPillenmiş proteinlerin tanımlanması için uygun karakteristik iyonlar üretir. AMP'nin kararlılığı nedeniyle, peptit parçalanma spektrumlarının manuel olarak veya arama motorlarıyla okunması kolaydır.
inhibitörleri
İnhibitör sabiti ile protein AMPylation (K inhibitörleri i 6 arasında) - 50 uM ve reklama kıyasla en az 30 kat seçicilik keşfedilmiştir.